Высокая плотность электролита в аккумуляторе
В процессе работы тяговых аккумуляторных батарей, при чередующихся
зарядах и разрядах, происходит окисление решеток и разрушение активных
масс, потеря механических связей между частицами, интенсивная коррозия
электродов. В результате чего происходит уменьшение емкости
аккумуляторов и короткое замыкание разноименных пластин.
Характерными признаками разрушения пластин являются:
электролит делается мутным и приобретает коричневую окраску из-за высыпания активной массы;
быстрое нарастание плотности электролита при заряде батареи;
резкое
понижение емкости АКБ, что проявляется в небольшой продолжительности
разряда аккумулятора, и как следствие сокращение времени работы
электротехники.
Скорость разрушения пластин зависит от условий эксплуатации аккумуляторов.
Причинами разрушения пластин в аккумуляторах могут быть:
Увеличенная плотность электролита ( более 1300 кг/м3). Нельзя доливать электролит в аккумулятор – только дистиллированную воду.
Нельзя доливать электролит в аккумулятор – только дистиллированную воду.
Повышение температуры аккумулятора выше 45 град. С. Если
при заряде температура электролита поднялась выше 45 град. С, то зарядку
необходимо прекратить и дать остыть электролиту до температуры ниже
35град. С. Затем продолжить заряд батареи.
Перезаряд аккумуляторной батареи из-за неправильного подбора или настройки зарядного устройства.
Заливка
не дистиллированной (водопроводной) воды в аккумуляторную батарею.
Этот процесс ускоряется при наличии в электролите таких вредных веществ,
как хлор, железо и др.
Замерзание воды в аккумуляторной батарее. Электролит плотностью 1,100г/см3 замерзает при температуре -7,7 град. С. Нельзя оставлять разряженную батарею более 12 часов даже в теплом помещении.
Удары и вибрации, т. к. происходит стряхивание активной массы свинца с решеток пластин.
Выпадение большого количества активного вещества на дно аккумулятора, что приводит к короткому замыканию пластин.
Повышенная плотность электролита вызывает коррозию решеток, сокращает срок службы и снижает качество работы аккумуляторов. Работа с электролитом повышенной плотности целесообразна только при низких температурах, так как такой электролит замерзает при более низкой температуре. [1]
Повышенная плотность электролита также вредна для деревянной сепарации. При длительном воздействии электролита повышенной плотности древесина обугливается и приобретает повышенную хрупкость. Комбинированная сепарация аккумуляторов типа СН от повышения плотности ( в пределах, могущих быть практически в эксплуатации) не страдает. [2]
Повышенная плотность электролита отрицательно сказывается на сроке службы аккумуляторной батареи, поэтому она устанавливается в зависимости от условий и требований эксплуатации. [3]
Интенсивное сульфатирование происходит также при повышенной плотности электролита , при колебании температуры электролита или наличии примесей в нем, а также при работе аккумулятора с пониженным уровнем электролита.
Преждевременное разрушение пластин наступает при длительном перезаряде батареи, повышенной плотности электролита , слабом креплении батареи на автомобиле, замерзании воды в электролите. [5]
Сульфатация пластин ускоряется при длительном хранении батареи без подзаряда, повышенной плотности электролита , большом саморазряде, соприкосновении пластин с воздухом и систематическом недозаряде батареи. [6]
При эксплуатации аккумуляторных батарей необходимо учитывать, что хранение их с повышенной плотностью электролита существенно сокращает срок службы. [7]
Сульфатация – образование на поверхности электродов крупных малорастворимых кристаллов сернокислого свинца – происходит при повышенной плотности электролита , длительном хранении батарей без подзаряда, систематическом недозаряде, наличии контакта электродов с воздухом вследствие пониженного уровня электролита. Батареи с сульфатированными электродами быстро теряют емкость при разряде. [8]
Наиболее вероятными причинами необратимой сульфатации могут служить: систематические недозаряды батареи, работа с повышенной плотностью электролита , усиленный саморазряд вследствие загрязнения электролита вредными примесями или коротких замыканий пластин, слишком низкий уровень электролита. [9]
[9]
В процесе эксплуатации необходимо следить, чтобы на заряд не отправлялись заряженные аккумуляторы, так как систематические перезаряды последних приводят к быстрому нарастанию плотности электролита за счет разложения воды в результате электролиза. Эксплуатация аккумуляторов с повышенной плотностью электролита является, как известно, причиной резкого сокращения срока службы аккумуляторов. Поэтому не следует также допускать эксплуатацию аккумуляторов в условиях положительной температуры окружающей среды с электролитом повышенной плотности, предусмотренным для зимних условий эксплуатации. [10]
Плотность электролита при этом должна быть не более 1 290, так как хранение батарей с повышенной плотностью электролита ускоряет разрушение пластин и сепараторов. [12]
Подготовка к корректировке.
Измерение уровня электролита.
Трубка для измерения уровня электролита.
Перед проверкой плотности электролита и в процессе её корректировки необходимо контролировать уровень электролита в банках аккумулятора.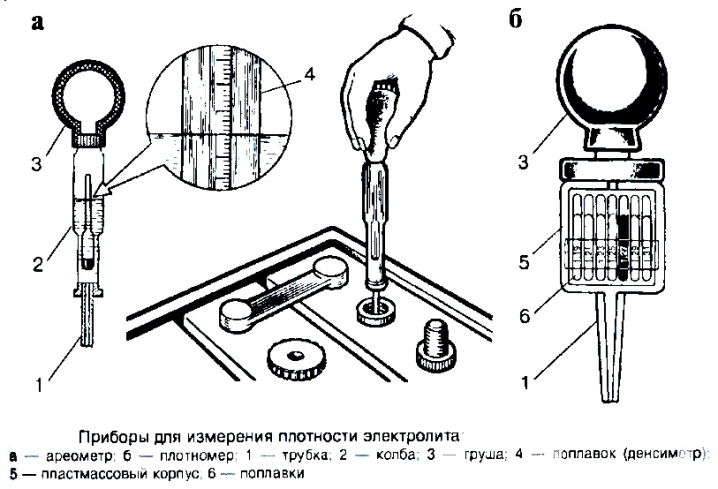 У автомобильных аккумуляторов принято считать нормальным уровень электролита на 10÷15 мм выше верхней кромки пластин (сепараторов).
У автомобильных аккумуляторов принято считать нормальным уровень электролита на 10÷15 мм выше верхней кромки пластин (сепараторов).
В батареях с индикатором (тубусом) электролит должен быть на одном уровне с ним или выше его на 5 мм.
Корректирующий электролит — электролит повышенной плотности (обычно 1,40 г/см3) для повышения плотности электролита АКБ или приготовления электролита нормальной плотности для заливки батарей.
Дистиллированная вода.
Добавляется в электролит для уменьшения его плотности.
1. В связи с тем что, кислота и вода имеют разную плотность, при разведении электролита или кислоты водой, следует добавлять кислоту в воду, но не наоборот.
2. Обращаться с аккумулятором нужно очень аккуратно. Его ни в коем случае нельзя переворачивать кверху дном. Это может привести к осыпанию пластин и последующему выходу аккумулятора из строя.
Определение необходимого значения плотности электролита полностью заряженного аккумулятора.
Весь период службы аккумулятора плотность электролита непрерывно меняется.
Но также существуют и необратимые изменения, например электролиз воды (разложение на водород и кислород) при «кипении» электролита. При этом плотность электролита повышается.
При сульфатации пластин, когда их активная поверхность покрывается слоем нерастворимого сульфата свинца или происходит осыпание активной массы пластин, что уменьшает площадь поверхности пластин, участвующую в электрохимической реакции — восстановление первоначальной плотности электролита в процессе заряда невозможно. Это приводит к необратимому снижению плотности электролита и, соответственно, сужает интервал изменения плотности в диапазоне полный разряд — полный заряд (0,15÷0,16 г/см3 — для нового, исправного аккумулятора).

Стабильно заниженная плотность приводит к снижению ЭДС и затруднению пуска двигателя, а также к повышению опасности замерзания электролита в зимний период эксплуатации.
Сначала нужно определиться, какую плотность электролита мы хотим иметь в нашей батарее применительно к климатической зоне её эксплуатации.
На этой таблице представлена температура замерзания электролита.
Например, для центральных районов России (Москва, Казань…) можно выбрать плотность электролита 1,25÷1,27 г/см3. Необходимо помнить, что на автомобиле аккумуляторная батарея, в лучшем случае, может быть заряжена на 80÷90 % её максимальной ёмкости (то есть плотность электролита будет чуть ниже, чем при полном заряде). Именно поэтому плотность электролита, исходя из температуры его замерзания (Таблица), выбирается чуть-чуть повыше, чем необходимо для обеспечения гарантированной незамерзаемости при минимальной температуре воздуха в зимний период.
Полная зарядка батареи.
Необходимо четко усвоить и неукоснительно соблюдать правило:
Проверка плотности электролита, с целью выяснения необходимости её корректировки, производится только у ПОЛНОСТЬЮ ЗАРЯЖЕННОЙ БАТАРЕИ.
Известно, что при исправном генераторном оборудовании автомобиля и его нормальном напряжении 14,0÷14,6 В, можно зарядить АКБ лишь на 80÷90 % её максимальной ёмкости из-за неэффективности процесса заряда батареи на автомобиле.
При выборе зарядного устройства следует избегать применения «автоматических зарядных устройств» без предварительного подробного ознакомления с логикой работы его автоматики. Во многих из них автоматическое выключение режима заряда производится просто при достижении напряжения на выводах батареи величины 14,5÷14,6 В, а это не всегда обеспечивает полный заряд АКБ.
Признаком ПОЛНОГО заряда аккумулятора является постоянство величины плотности электролита и напряжения на его выводах при продолжающемся заряде в течение 2 часов.
При достижении условий полного заряда батареи, то есть постоянства напряжения на выводах и плотности электролита в течение двух часов при продолжающемся заряде, его прекращают и выдерживают батарею от 30 минут до двух часов в отключенном состоянии.
Выдержку в отключенном состоянии в течение от получаса до двух часов рекомендуется выполнять после заряда (разряда), заливки (корректировки плотности) электролита, корректировки уровня электролита. Это делается для выравнивания плотности электролита в объёме банок, снижения температуры электролита, выхода пузырьков газов, образовавшихся при «кипении». В противном случае возможно возникновение недопустимых погрешностей в измерении плотности и уровня электролита, а также напряжения на выводах АКБ.
Затем измеряется уровень электролита и его плотность в каждой банке. Если замечена значительная разница в плотности электролита между банками (более 0,01 г/см3), следует попытаться провести дополнительную, так называемую выравнивающую зарядку АКБ для выравнивания плотности между банками, при этом ток заряда можно уменьшить в 2÷3 раза по сравнению с номинальным, для уменьшения газообразования («кипения»).
Если дополнительный заряд в течение нескольких часов не приводит к выравниванию плотности электролита в банках, очевидно, требуется выровнять её путем последующей корректировки.
В заключение этого этапа работы составляется табличка с указанием плотности и уровня электролита в каждой банке. Принимается решение, какие действия производить над каждой конкретной банкой. Основанием является соотношение величины плотности электролита, принятой нами за оптимальный вариант для нашей климатической зоны, и реальной, измеренной после полного зарядааккумулятора.
Корректировка плотности электролита.
Суть корректировки плотности электролита в банке аккумулятора заключается в следующем:
а) из банки забирается некоторый объём электролита;
б) вместо него в банку добавляется тот-же объём либо дистиллированной воды (плотность 1,00 г/см3) — для понижения плотности электролита в банке, либо корректирующего электролита (обычно плотностью 1,40 г/см3) — для повышения плотности;
в) батарея включается на 30 минут на заряд номинальным током для лучшего перемешивания электролита в результате газовыделения;
г) батарея отключается от зарядного устройства и выдерживается 0,5÷2 часа для выравнивания плотности электролита в объёме банок;
д) измеряется плотность электролита в каждой банке и его уровень, оба параметра приводятся в норму.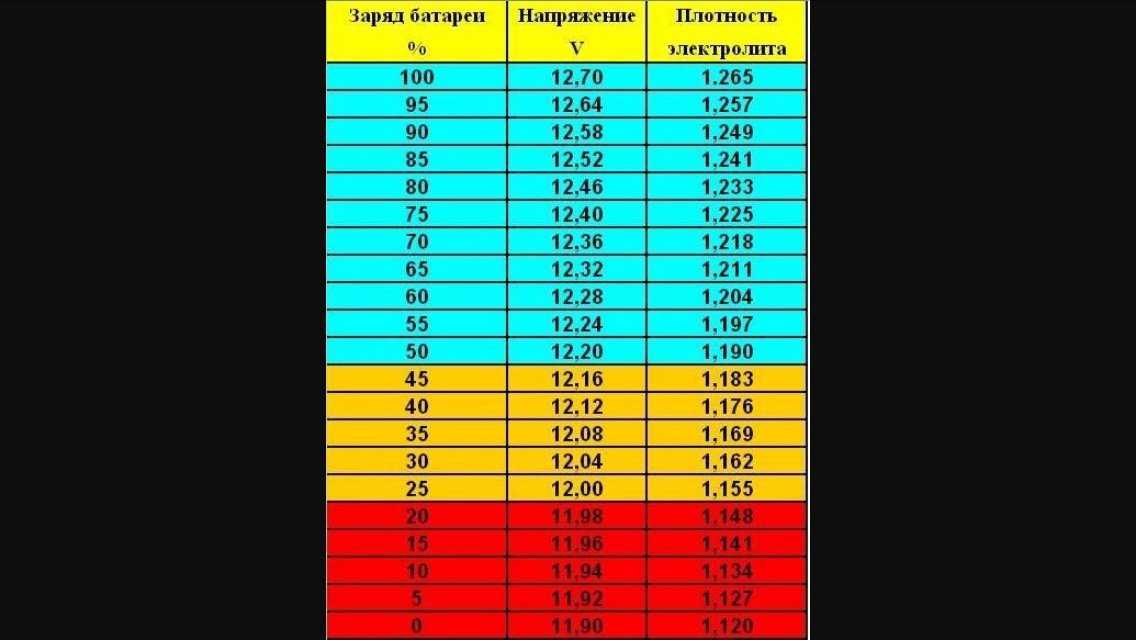 То есть, при необходимости, все операции а)÷д) повторяются.
То есть, при необходимости, все операции а)÷д) повторяются.
Приведу таблица, в которой указано, «…сколько вешать в граммах», то есть указано конкретное количество в см3 удаляемого электролита и соответствующее количество доливаемой жидкости (дистиллированная вода или корректирующий электролит — в зависимости от направления изменения плотности).
Объёмы жидкостей указаны для корректировки 1 литра электролита (1000 см3). Таким образом, чтобы провести коррекцию конкретной батареи нам необходимо знать объём электролита в одной банке этой батареи в литрах. Полученные из таблицы значения необходимо умножить на объем электролита в литрах в одной банке корректируемой батареи.
Объём электролита в одной банке:
6СТ-45 — 500 см3;
6СТ-55 — 633 см3.
Примерные нормы в см3 корректировки плотности электролита в объеме 1 литра.
Таблица предусматривает использование корректирующего электролита плотностью только 1,40 г/см3. Ниже приведена формула, при использовании которой можно применять корректирующий электролит с плотностью, отличной от 1,40 г/см3.
где
Vэ — объём удаляемого из банки электролита, см3,
Vб — объём электролита в одной банке, см3,
для некоторых типов аккумуляторов объём электролита в одной банке указан чуть выше по тексту,
ρн — начальная плотность электролита до корректировки, г/см3,
ρк — конечная плотность, которую надо получить, г/см3,
ρд — плотность доливаемой жидкости, (вода — 1,00 г/см3 или корректирующий электролит — * г/см3)
Следует учесть, что при использовании данной формулы объёмы удаляемого и добавляемого электролитов равны.
Если с таблицей разобраться сложно! То можно сделать прощё :
Откачайте большую часть жидкости из одной из банок. Эту операцию удобно выполнять с помощью “груши”. Замерьте выкачанный объем и долейте примерно половину от этого объема электролитом. Аккуратно покачайте аккумулятор в разные стороны, затем замерьте плотность снова. Если плотность не достигла требуемого значения, долейте еще ¼ от выкачанного ранее объема электролитом. Таким образом, следует доливать электролит, каждый раз уменьшая его количество в два раза.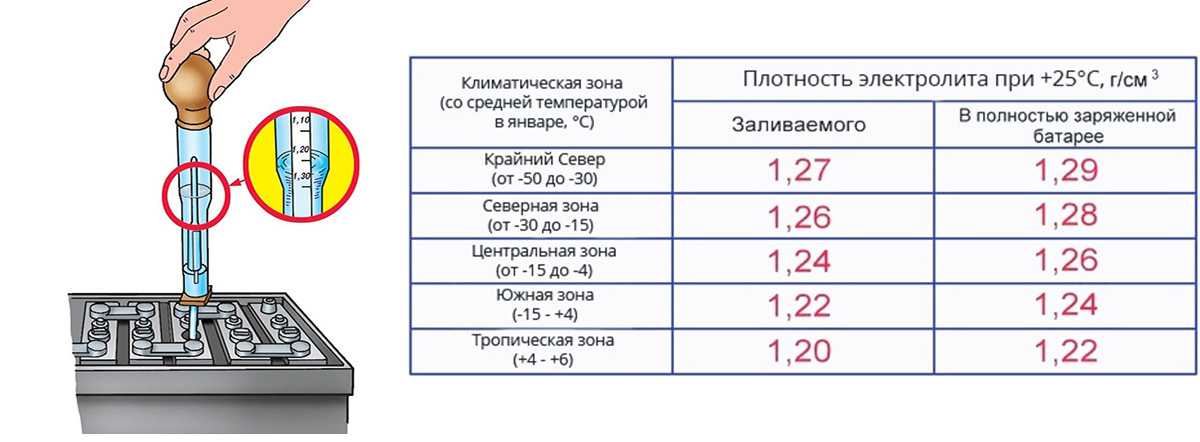
Какая должна быть плотность электролита в аккумуляторе автомобиля?
Содержание
- Оптимальные показатели в зависимости от времени года
- Летом
- Зимой
- Почему происходит изменение плотности электролита?
- Как можно откорректировать плотность электролита в банках батареи?
- Чем грозит повышенная или пониженная плотность электролита?
Оптимальные показатели в зависимости от времени года
Плотность является важным параметром всех аккумуляторных батарей, значение которого рекомендуется удерживать на оптимальном уровне. Такое положение объясняется двумя основными причинами. Во-первых, значение параметра зависит от периода времени, в течение которого батарея будет стабильно функционировать. Во-вторых, уровень плотности определяет качество ёмкости АКБ, которое может постепенно падать из-за неоптимальной величины параметра.
Плотность электролита в аккумуляторе равна 1,27–1,31 г/см3. Однако такие значения соответствуют норме в регионах с умеренным климатическим режимом. Если эксплуатировать автомобиль в районах, в которых температурный режим может достигать -50, то плотность электролита в АКБ там от 1,29 до 1,31 г/см3. Норма устанавливается в зависимости от климатических особенностей района и времени года.
Если эксплуатировать автомобиль в районах, в которых температурный режим может достигать -50, то плотность электролита в АКБ там от 1,29 до 1,31 г/см3. Норма устанавливается в зависимости от климатических особенностей района и времени года.
Также у водителей может появиться вопрос, какая плотность электролита в аккумуляторе должна быть в разное время года. Проанализируем этот показатель летом и зимой.
Летом
Нормальная плотность электролита в аккумуляторе изменяется в интервале от 1,25 до 1,27 г/см3 в жаркий сезон. Но летом АКБ может работать нестабильно, так как существует вероятность возникновения проблем, связанных с потерей значительного количества жидкости. Специалисты советуют удерживать значение параметра на 0,02–0,03 г/см3 ниже оптимального. Нельзя не отметить, что данная рекомендация преимущественно относится к южным регионам нашей страны.
Приводим таблицу плотности электролита в аккумуляторе в летнее время.
| Регион | Величина плотности, г/см3 |
|---|---|
| Центральный | 1,27 |
| Южный | 1,25 |
| Северный | 1,27 |
| Крайний Север | 1,27 |
Зимой
Какая должна быть плотность аккумулятора в зимний сезон? Она не должна опускаться ниже 1,27 г/см3.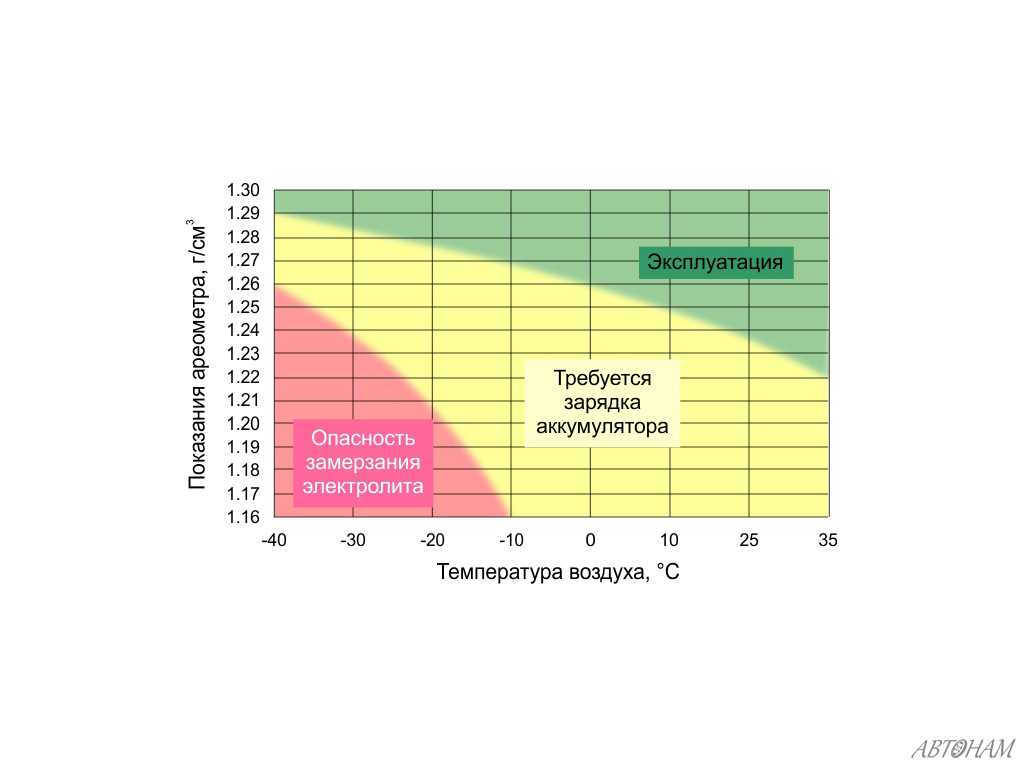 Исключением являются южные регионы, в которых значение показателя может составлять 1,25 г/см3.
Исключением являются южные регионы, в которых значение показателя может составлять 1,25 г/см3.
Если рассматривать районы Крайнего Севера, то плотность аккумулятора должна находиться в промежутке от 1,31 г/см3 до 1,35 г/см3. Такое положение объясняется несколькими причинами. Во-первых, если значение показателя будет слишком маленьким, то электролит внутри АКБ при крепком морозе может превратиться в ледышку, так как доля жидкости в нём в несколько раз превышает норму. Во-вторых, основные части и механизмы автотранспортного средства замерзают при минусовых температурах. Чтобы этого не произошло, необходимо усилить электродвижущую силу, с помощью которой можно осуществить запуск двигателя внутреннего сгорания. Даже современные машины не смогут это реализовать без дополнительной энергии. Следовательно, если уменьшить значение показателя, то произойдёт замерзание АКБ.
Таким образом, отвечая на вопрос о том, сколько должно быть электролита в аккумуляторе, приведём следующую таблицу плотности.
| Регион | Величина плотности, г/см3 |
|---|---|
| Центральный | 1,27 |
| Южный | 1,25 |
| Северный | 1,29 |
| Крайний Север | 1,31 |
Но нужно помнить, что представленные цифры относятся лишь к АКБ с полным зарядом. Если он находится на недостаточном уровне, то значения показателя будут больше на несколько единиц.
Почему происходит изменение плотности электролита?
Даже многие водители со стажем не знают, почему падает плотность электролита в аккумуляторе. Это происходит в результате уменьшения заряда АКБ. Подобные перемены характерны для зимы, когда при потере значительной величины энергии значение рассматриваемого показателя становится критическим. Единственным решением этой проблемы является регулярный контроль состояния аккумулятора.
Специалисты рекомендуют время от времени отслеживать взаимосвязь между уровнем заряда и водным соотношением в составе электролита.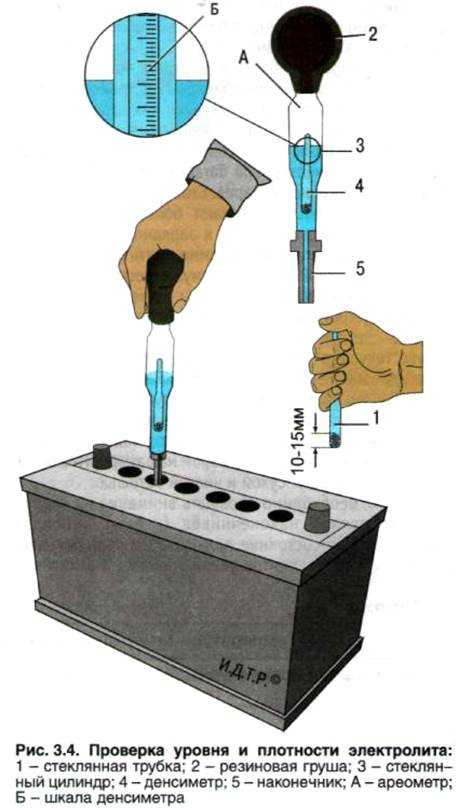 К примеру, рассмотрим возможное развитие событий при сокращении аккумулятора на 25 % и 50 %:
К примеру, рассмотрим возможное развитие событий при сокращении аккумулятора на 25 % и 50 %:
- При первоначальной плотности в 1,30 г/см3 она снизится до 1,26 г/см3 и 1,22 г/см3.
- При начальном значении показателя в 1,27 г/см3 объём уменьшится до 1,23 г/см3 и 1,19 г/см3.
- При исходной величине в 1,23 г/см3 плотность упадёт до 1,19 г/см3 и 1,15 г/см3.
Таким образом, необходимо своевременно осуществлять зарядку аккумулятора, чтобы избежать падения показателя. Однако перед этим рекомендуется обратить внимание на уровень жидкости, который мог уменьшиться в процессе функционирования автомобиля. Если это произошло, требуется долить очищенную воду без содержания каких-либо добавок.
Как можно откорректировать плотность электролита в банках батареи?
Часто возникают ситуации, в которых наблюдается разная плотность электролита в банках аккумулятора. Эту проблему нужно решать незамедлительно. Как тогда выровнять плотность электролита в банках аккумулятора? Рекомендуется два варианта действий:
- Применить электролит, обладающий высокой концентрацией серы.

- Долить кислоты вспомогательного характера.
Корректировка плотности электролита в аккумуляторе осуществляется с использованием следующих предметов:
- специальная ёмкость с делениями;
- резервуар для образования новой субстанции;
- кислота, электролит;
- очищенная жидкость.
Инструкция по изменению значения показателя включает в себя следующие действия:
- Взять небольшое количество электролита с банки аккумуляторной батареи.
- Добавить корректирующий раствор в количестве, которое соответствует взятому на первом действии – если необходимо увеличить плотность электролита. Для противоположного результата регулирующий раствор замените на дистиллированную жидкость.
- Аккумулятор следует подзарядить специальным устройством, так как номинальный ток позволит поступившей воде перемешаться.
- Отключив АКБ от батареи, целесообразно выждать в районе 2 часов. Это позволит плотности во всех банках встать на один уровень, что сделает вероятность возникновения погрешностей при контрольном измерении минимальной.

- Заново измерить значение электролита. Если оно прежнее – повторить предыдущие действия сначала.
Не всегда можно изменить показатель. И тогда единственное решение – купить новый аккумулятор. Если электролит приобретает чёрный оттенок при осуществлении зарядки, то это свидетельствует о невозможности восстановления работы АКБ.
Чем грозит повышенная или пониженная плотность электролита?
Если рассматриваемый показатель выше допустимого значения, то значит, норма превышена, что отрицательно сказывается на функционировании авто. Это в большинстве случаев приводит к возникновению различных неисправностей АКБ. Следовательно, слишком высокая плотность электролита в аккумуляторе опасна для состояния автомобиля.
Если значение показателя занижено, машина может просто не завестись. В первую очередь это касается зимнего сезона, так как батарея замёрзнет при минусовых температурах.
Таким образом, необходимо осуществлять регулярную проверку плотности электролита. Это поможет избежать возникновения непредвиденных обстоятельств. Однако сделать подобное проблематично, так как плотность изменяется при разных уровнях заряда аккумулятора. Например, при её уменьшении происходит поглощение дистиллированной жидкости батареей, что приводит к увеличению концентрации показателя. В обратных ситуациях возникает процесс сульфатации, ведущий к снижению уровня плотности. Главный исход – выход из строя АКБ.
Перемешивается ли электролит в аккумуляторе при движении автомобиля? / Хабр
Привет, Хабр! Серная кислота почти вдвое тяжелее воды, и её водные растворы, в том числе аккумуляторный электролит, склонны к расслоению: тяжёлая кислота вытесняет лёгкую воду вверх и опускается вниз. Как это влияет на работу аккумуляторной батареи, и насколько эффективно перемешивает электролит тряска при движении транспортного средства? Проведём эксперимент с видео и показаниями приборов.
▍Перед началом опыта, вспомним известные факты о расслоении электролита:
❒ Основная токообразующая реакция в свинцовом аккумуляторе, — двойная сульфатация по Гладстону-Трайбу, — требует для заряда воды, которая расходуется из электролита с выделением кислоты, а при разряде наоборот, расходуется кислота и выделяется вода.
❒ Обязательными условиями заряда участка активной массы являются наличие в этом участке воды, а также электрический потенциал не ниже необходимого для преодоления термодинамической электродвижущей силы — ЭДС — на этом участке. ЭДС тем выше, чем выше концентрация кислоты.
❒ Следовательно, повышенная концентрация электролита в нижней части банок и глубине намазок пластин АКБ — аккумуляторной батареи — ведёт к тому, что для преодоления термодинамической ЭДС требуется более высокое напряжение на клеммах. При недостаточном напряжении заряд участка активной массы (АМ) с повышенной концентрацией кислоты не произойдёт никогда.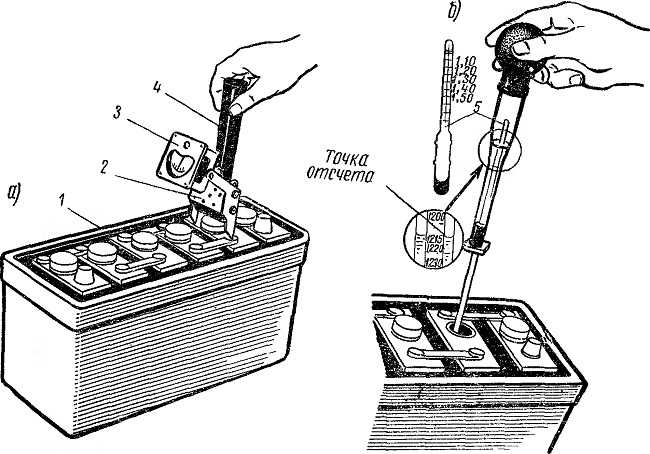 Также препятствует заряду и недостаток воды в данном участке АМ.
Также препятствует заряду и недостаток воды в данном участке АМ.
❒ И заряд, и разряд активных масс ведут к расслоению электролита, так как выделяющаяся при заряде кислота стремится вниз, а образующаяся при разряде вода — вверх. Таким образом, если не предпринять специальных мер, при любой глубине циклирования или просто саморазряде АКБ расслоение электролита прогрессирует.
❒ Современные типы АКБ характеризуются плотными сепараторами, препятствующими оплыванию активных масс и короткому замыканию. Они повышают надёжность, виброустойчивость и срок службы АКБ, но и препятствуют перемешиванию электролита, усугубляя тенденцию к расслоению.
❒ Чем более прогрессирует расслоение электролита, тем большая доля активных масс при штатном зарядном напряжении не заряжается, то есть, остаётся в виде сульфата свинца, склонного переходить в труднорастворимую форму. Это явление называется сульфатацией. Не следует путать с двойной сульфатацией п. 1 — нормальной токообразующей реакцией.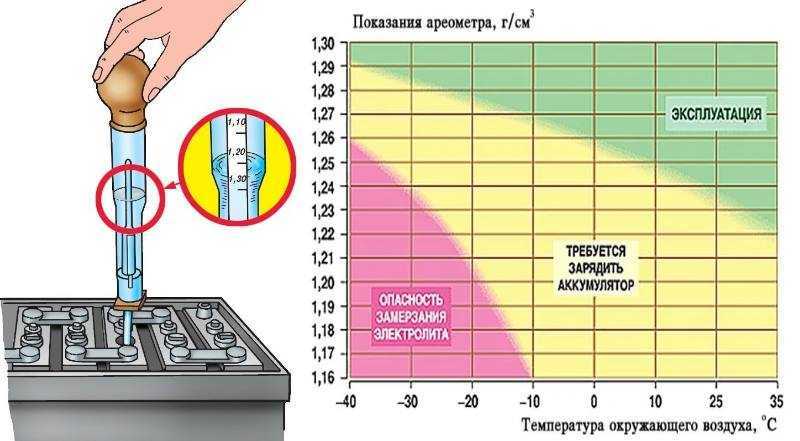 Сульфаты имеют меньшую плотность, чем заряженные АМ — губчатый свинец отрицательных пластин и оксид свинца положительных, потому сульфатированные намазки увеличиваются в объеме, что ведёт к разрушению конструкции аккумулятора и коротким замыканиям. П. 5 этому препятствует, но при отсутствии периодического выравнивающего заряда АКБ с расслоением и сульфатацией теряет ёмкость, токоотдачу и концентрацию кислоты в верхних слоях электролита.
Сульфаты имеют меньшую плотность, чем заряженные АМ — губчатый свинец отрицательных пластин и оксид свинца положительных, потому сульфатированные намазки увеличиваются в объеме, что ведёт к разрушению конструкции аккумулятора и коротким замыканиям. П. 5 этому препятствует, но при отсутствии периодического выравнивающего заряда АКБ с расслоением и сульфатацией теряет ёмкость, токоотдачу и концентрацию кислоты в верхних слоях электролита.
❒ Электролит с низкой концентрацией кислоты замерзает при более высокой («менее минусовой») температуре, потому расслоение электролита ведёт к выходу аккумулятора из строя в зимнее время.
По просторам Всемирной Паутины с давних времён гуляет множество мифов о губительности «кипячения», — заряда с перенапряжением и выделением водорода и кислорода, пузырьки которых перемешивают электролит, для автомобильных АКБ. Многие руководствуются этими мифами при заряде АКБ и выборе для этого зарядных устройств — ЗУ.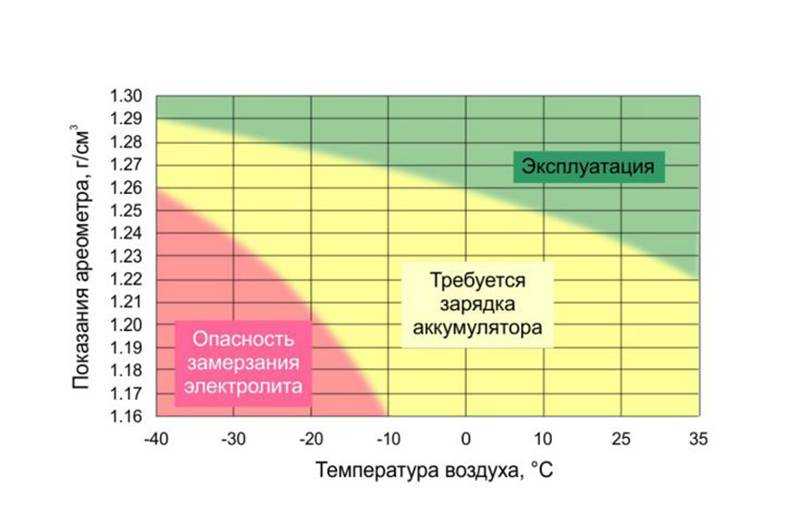
Отчасти поэтому, во многих моделях ЗУ производители ограничивают напряжение на уровне, не допускающем «кипения» электролита, в других моделях предоставляют пользователю выбор максимальных напряжений заряда путём ступенчатого переключения или плавной регулировки, даже если ЗУ представляет собой не просто источник питания со стабилизацией тока и напряжения (СС/CV), а имеет алгоритмы автоматического управления напряжением и током согласно табличным значениям профиля или на основании измерения характеристик АКБ.
Водород, аэрозоль серной кислоты и сероводород, могущие выделяться при заряде аккумулятора, действительно опасны, потому заряжать следует в проветриваемом помещении, адекватно управлять током, напряжением и временем заряда, изучить и соблюдать технику безопасности.
В сегодняшнем эксперименте посмотрим, насколько перемешают электролит пара современных отечественных ЗУ, и насколько это требуется от ЗУ вообще, применительно к стартерной аккумуляторной батарее. Ведь она монтируется на автомобиле (мотоцикле, снегоходе, катере.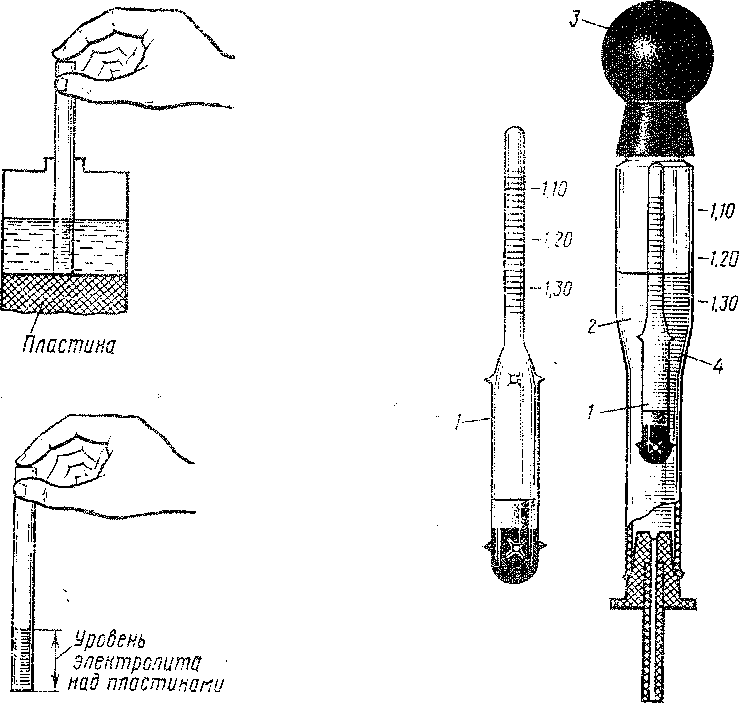 ..), а тот испытывает ускорения и вибрации при движении. Некоторые авторы считают, что поездки перемешают электролит, потому в функции зарядного устройства это не входит. Давайте попробуем, и узнаем.
..), а тот испытывает ускорения и вибрации при движении. Некоторые авторы считают, что поездки перемешают электролит, потому в функции зарядного устройства это не входит. Давайте попробуем, и узнаем.
Подопытным будет аккумулятор АКОМ +EFB 6СТ-60VL. Со времени предыдущего стационарного обслуживания он использовался на автомобиле 4 месяца. График работы владельца автомобиля — сутки через трое, каждая поездка занимала 20 минут. Стартер и сигнализация за трое суток простоя в каждом таком цикле расходовали примерно 3 ампер*часа.
Начнём с измерения параметров текущего состояния. И как всегда, в первую очередь вымоем корпус и зачистим клеммы.
Напряжение разомкнутой цепи — НРЦ, оно же ЭДС без нагрузки, по показаниям трёх приборов 12.48, 12.50, 12.52 В.
Плотность электролита по банкам колеблется от 1.22 до 1.23. В крайних банках плотность ниже, в средних выше. Это тенденция, обычная для свинцовых батарей.
Это тенденция, обычная для свинцовых батарей.
Итак, наблюдаем расхождение: НРЦ соответствует уровню заряженности выше 80%, плотность электролита при котором должна быть 1.24, а по плотности уровень заряженности получается 75%, НРЦ должно быть 12.4 В. Причиной такого несоответствия как раз является расслоение электролита за 4 месяца эксплуатации под капотом. Повышенная концентрация кислоты в нижней части банок создаёт завышенное НРЦ. АКБ в таком состоянии необходим стационарный заряд.
Напряжение под нагрузочной вилкой не падает ниже 10 вольт, аккумулятор способен крутить стартер. Но если почитать инструкцию от производителя, то там чётко и ясно написано: если плотность ниже 1.25, аккумулятор требуется зарядить до плотности 1.28. Также в инструкции сказано, что можно оценить степень заряда по напряжению, и рекомендуется производить стационарный заряд при НРЦ ниже 12.5, но если имеется доступ к электролиту, то лучше проверить его плотность.
Приступаем к заряду зарядным устройством BL1204 на программе 2.
Заряд длился 9 часов. Плотность по банкам составила от 1.23 до 1.24.
По графику напряжения на клеммах, видно, что ЗУ производит основной заряд с подачами и паузами разной продолжительности, а затем три этапа непрерывного дозаряда, после чего последовали тест АКБ и буферный режим 13.65 В. Однако для кальциевой АКБ до 14.8 вольт происходит лишь основной заряд, потому продолжим заряд на программе 4.
Время заряда составило 1 час 16 минут плюс 20 часов в режиме буферного хранения. Плотность поднялась ещё на одну сотую и составила от 1.24 до 1.25. Сделаем ещё один проход на 4-й программе.
Время заряда снова 1 час 16 минут. Плотность поднялась всего на 0.005. Перезапустим программу 4 в третий раз.
Третий проход длился те же 1 час 16 минут. Плотность снова поднялась на 0.005. Отключаем ЗУ от АКБ. После отстоя продолжительностью 18 часов 20 минут НРЦ 13.20 В. При плотности 1.25 это говорит об очень сильном расслоении электролита. Запустим программу 4 ещё раз.
Плотность снова поднялась на 0.005. Отключаем ЗУ от АКБ. После отстоя продолжительностью 18 часов 20 минут НРЦ 13.20 В. При плотности 1.25 это говорит об очень сильном расслоении электролита. Запустим программу 4 ещё раз.
Заряд длился на этот раз около 50 минут. Плотность электролита не поднялась. Попробуем воспользоваться другим ЗУ.
Возьмём Бережок-V, установим 15.9 В — то же максимальное напряжение, что у BL1204.
Ток изменяется от -0.2 до 4.5 ампер. Отрицательное значение тока — не ошибка токовых клещей, а разрядные импульсы в асимметричном (реверсивном) заряде.
Заряд длился 4 часа, за которые ЗУ сделало две длительные паузы, и затем перешло в режим хранения — не поддержание буферного напряжения, как BL1204, а периодический подзаряд.
В пиках напряжение достигает тех же 15.9.
Плотность в 5 банках составила 1. 26 или чуть выше, и в одной 1.255. Оставим АКБ на ночь дозаряжаться в режиме хранения.
26 или чуть выше, и в одной 1.255. Оставим АКБ на ночь дозаряжаться в режиме хранения.
По прошествии 15 часов, импульсы тока доходят до 5 А, снижаясь менее чем за секунду до 1 А.
Для отбора проб электролита из глубины банок воспользуемся удлинённой пипеткой, гибкий наконечник которой может пройти сбоку от пластин. Короткой пипеткой произведём отбор, как обычно, из верхнего слоя.
Плотность верхнего слоя составила 1.26, нижнего почти 1.31. Это весьма значительное расслоение, обуславливающее высокое напряжение разомкнутой цепи при недозаряженных и сульфатирующихся нижних частях пластин. Ни одно из применённых ЗУ при заряде нашего аккумулятора до 15.9В с расслоением не справилось.
Устранят ли поездки такое расслоение? Для непосредственной проверки установим АКБ под капот, для чего пришлось удлинить провод массы.
Для лучшего перемешивания прибавим напряжение бортовой сети с 14. 3 до 14.8 В, так как это позволяет сделать трёхуровневый регулятор напряжения.
3 до 14.8 В, так как это позволяет сделать трёхуровневый регулятор напряжения.
Приборная панель Gamma GF-618 позволяет регистрировать данные поездок, что тоже очень пригодится в нашем эксперименте.
Пробег за трое суток в городском режиме составил 143.7 километра. Большое количество разгонов и торможений должно способствовать перемешиванию электролита.
Израсходовано 12.8 литров бензина.
После таких поездок плотность на глубине составила 1.29.
Плотность сверху 1.27. Предписываемого инструкцией значения 1.28 так и не достигли. Расслоение до сих пор присутствует. Покатаемся ещё трое суток, на этот раз, не только по городу, но и по трассе.
Итого за 6 суток автомобиль двигался восемь с половиной часов.
Общий пробег за это время 377. 8 км.
8 км.
Бензина затрачено 28.8 литра.
Плотность электролита наверху и внизу, наконец, уравнялась, и составила чуть ниже 1.27.
Итак, чтобы устранить расслоение в Ca/Ca EFB аккумуляторе после нескольких перезапусков стационарного заряда до 15.9 вольт, понадобилось почти 378 километров пробега и 29 литров бензина при напряжении бортсети 14.8 В. Сделаем выводы:
Q: Перемешивается ли электролит в современном кальциевом аккумуляторе с высокой плотностью сепараторов и упаковки пластин при движении транспортного средства?
— Да, действительно перемешивается.
Q: Насколько такое перемешивание эффективно?
— Мягко говоря, не очень.При более низком напряжении бортовой сети и более коротких поездках расслоение электролита продолжило бы прогрессировать
Q: Остались ли после всех стараний в испытуемом аккумуляторе недозаряд и сульфатация?
— Да, остались.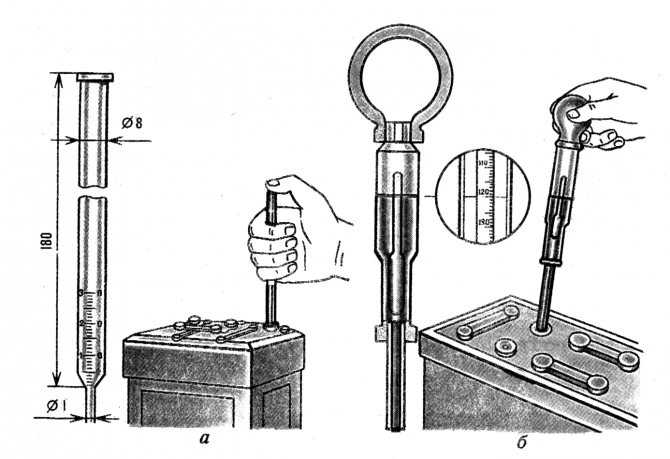 Чтобы считать данную АКБ заряженной, мы должны получить плотность верхних слоёв не менее 1.28.
Чтобы считать данную АКБ заряженной, мы должны получить плотность верхних слоёв не менее 1.28.
Q: Проявляют ли EFB аккумуляторы, вместе со склонностью к расслоению электролита, заявленную стойкость к длительному недозаряду (PSoC, partial state of charge, состояние частичной заряженности) и циклированию с глубокими разрядами?
— Да, как показывают другие наши исследования, которые продолжаются, уже выложено несколько видео, и готовятся следующие видео и статьи.
Q: Тем не менее, будут ли ёмкость, токоотдача и устойчивость к замерзанию электролита деградировать если не предпринимать периодических регламентных процедур по полному стационарному заряду?
— Будут, у любого свинцово-кислотного аккумулятора, потому что препятствует замерзанию концентрация кислоты в растворе, полезная ёмкость обеспечивается количеством заряженных (десульфатированных) активных масс, а способность отдавать ток полезной нагрузке и оперативно восполнять затраченную энергию от генератора автомобиля или иного зарядного устройства — действующей площадью активных масс. На ёмкость и токоотдачу влияет доступность воды для заряда и кислоты для разряда, т.е. расслоение электролита напрямую вредит этим ключевым для химического источника тока параметрам.
На ёмкость и токоотдачу влияет доступность воды для заряда и кислоты для разряда, т.е. расслоение электролита напрямую вредит этим ключевым для химического источника тока параметрам.
Теперь давайте всё-таки продолжим заряд данной аккумуляторной батареи. На этот раз начнёт Бережок-V, при том же напряжении окончания заряда 15.9 В.
Заряд продолжался около 4 часов, плюс 4 часа в хранении.
Плотность поднялась с чуть ниже 1.27 до 1.275. Передаём эстафетную палочку BL1204.
Заряд длился около часа, и далее 14 часов в режиме хранения.
Плотность осталась 1.275.
Установим на Бережке-V ограничение напряжения 16.7 вольт и запустим заряд.
По прошествии 4 часов ЗУ автоматически перешло в режим хранения. Плотность и над пластинами, и на глубине чуть выше 1.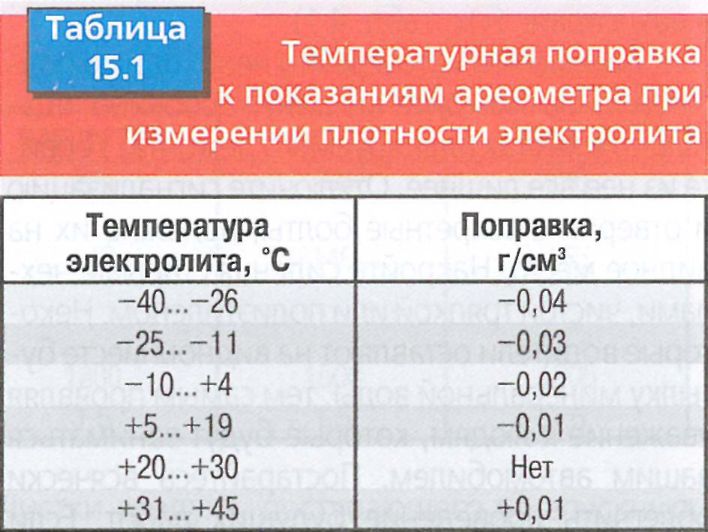 28. Электролит перемешан, расслоение устранено.
28. Электролит перемешан, расслоение устранено.
Адекватный стационарный заряд не только перемешивает электролит эффективнее, чем ускорения и вибрации при движении транспортного средства, но и позволяет более полно зарядить аккумуляторную батарею, устранить сульфатацию, поднять эксплуатационные характеристики.
Спустя сутки, имеем следующие показания тестера:
Здоровье 100%, внутреннее сопротивление 4.81 мОм, ток холодной прокрутки 574 из 560 А по стандарту EN. НРЦ 12.80 В соответствует плотности 1.28. Расслоения нет, АКБ в полном порядке, можно ставить под капот.
Статья составлена в сотрудничестве с аккумуляторщиком Виктором VECTOR, осуществившим описанные опыты.
Плотность электролита в аккумуляторе
Автомобильная батарея, известная как аккумулятор, отвечает за системы запуска, освещения и зажигания в машине. Как правило, автомобильные аккумуляторы являются свинцово-кислотными, состоят из гальванических элементов, обеспечивающих 12-вольтовую систему. Каждая из ячеек создает 2,1 В при полной зарядке. Плотность электролита – контролируемое свойство водно-кислотного раствора, обеспечивающее нормальную работу батарей.
Каждая из ячеек создает 2,1 В при полной зарядке. Плотность электролита – контролируемое свойство водно-кислотного раствора, обеспечивающее нормальную работу батарей.
Состав свинцово-кислотной батареи
Электролит свинцово-кислотной аккумуляторной батареи представляет собой раствор серной кислоты и дистиллированной воды. Удельный вес чистой серной кислоты составляет около 1,84 г/см3, и эту чистую кислоту разбавляют дистиллированной водой до тех пор, пока удельный вес раствора не станет равным 1,2-1,23 г/см3.
Хотя в некоторых случаях плотность электролита в аккумуляторе рекомендуется в зависимости от типа батареи, сезонного и климатического состояния. Удельный вес полностью заряженной батареи по промышленному стандарту в России — 1,25-1,27 г/см3 летом и для суровых зим- 1,27-1,29 г/см3.
Удельный вес электролита
Одним из основных параметров работы батареи является удельный вес электролита. Это отношение веса раствора (серной кислоты) к весу равного объема воды при определенной температуре. Обычно измеряется с помощью ареометра. Плотность электролита используется в качестве индикатора состояния заряда ячейки или батареи, однако не может характеризовать емкость аккумулятора. Во время разгрузки удельный вес уменьшается линейно.
Обычно измеряется с помощью ареометра. Плотность электролита используется в качестве индикатора состояния заряда ячейки или батареи, однако не может характеризовать емкость аккумулятора. Во время разгрузки удельный вес уменьшается линейно.
Учитывая это, нужно уточнить размер допустимой плотности. Электролит в батарее не должен превышать 1,44 г/см3. Плотность может составлять от 1,07 до 1,3 г/см3. Температура смеси при этом будет составлять около +15 С.
Электролит повышенной плотности в чистом виде характеризуется довольно высокой величиной этого показателя. Его плотность составляет 1,6 г/см3.
Степень заряженности
При полностью заряженном стационарном режиме и при разряде измерение удельного веса электролита дает приблизительное указание на состояние заряда ячейки. Удельный вес = напряжение разомкнутой цепи — 0,845.
Пример: 2,13 В — 0,845 = 1,285 г/см3.
Удельный вес уменьшается при разрядке батареи до уровня, близкого к значению чистой воды, и увеличивается во время перезарядки.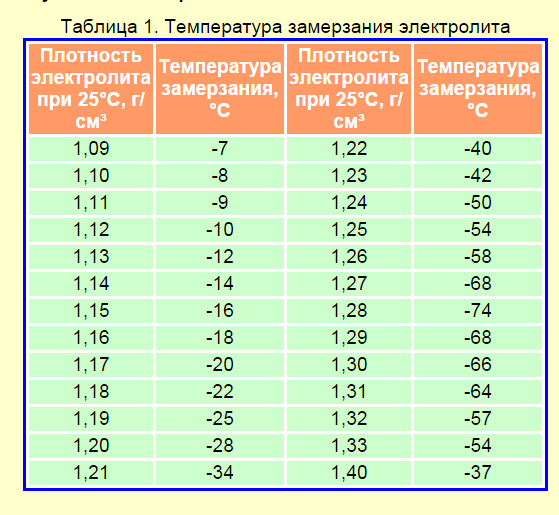 Аккумулятор считается полностью заряженным, когда плотность электролита в аккумуляторе достигает максимально возможного значения. Удельный вес зависит от температуры и количества электролита в ячейке. Когда электролит находится вблизи нижней отметки, удельный вес выше, чем номинальный, он падает, и воду добавляют в ячейку, чтобы довести электролит до требуемого уровня.
Аккумулятор считается полностью заряженным, когда плотность электролита в аккумуляторе достигает максимально возможного значения. Удельный вес зависит от температуры и количества электролита в ячейке. Когда электролит находится вблизи нижней отметки, удельный вес выше, чем номинальный, он падает, и воду добавляют в ячейку, чтобы довести электролит до требуемого уровня.
Объем электролита расширяется, когда температура поднимается, и сжимается с понижением температуры, что влияет на плотность или удельное значение силы тяжести. По мере расширения объема электролита показания снижаются и, наоборот, удельный вес увеличивается при более низких температурах.
Перед тем как поднять плотность электролита в аккумуляторе, необходимо выполнить замеры и расчеты. Удельный вес для батареи определяется приложением, в котором он будет использоваться, с учетом рабочей температуры и срока службы батареи.
% Серная кислота | % Вода | Удельный вес (20 ° С) |
37,52 | 62,48 | 1,285 |
48 | 52 | 1,380 |
50 | 50 | 1,400 |
60 | 40 | +1,500 |
68,74 | 31,26 | 1,600 |
70 | 30 | 1,616 |
77,67 | 22,33 | 1,705 |
93 | 7 | 1,835 |
Химическая реакция в аккумуляторах
Как только нагрузка подключается через клеммы аккумулятора, разрядный ток начинает течь через нагрузку, и аккумулятор начинает разряжаться. Во время процесса разрядки кислотность раствора электролита уменьшается и приводит к образованию сульфатных отложений как на положительных, так и на отрицательных пластинах. В этом процессе разряда количество воды в растворе электролита увеличивается, что уменьшает его удельный вес.
Во время процесса разрядки кислотность раствора электролита уменьшается и приводит к образованию сульфатных отложений как на положительных, так и на отрицательных пластинах. В этом процессе разряда количество воды в растворе электролита увеличивается, что уменьшает его удельный вес.
Ячейки аккумуляторной батареи могут быть разряжены до заданного минимального напряжения и удельного веса. Полностью заряженная свинцово-кислотная аккумуляторная батарея имеет напряжение и удельный вес, 2,2 В и 1,250 г/см3 соответственно, и эта ячейка обычно может разряжаться до тех пор, пока соответствующие значения не достигнут 1,8 В и 1,1 г/см3.
Состав электролита
Электролит содержит смесь серной кислоты и дистиллированной воды. Данные не будут точными при замерах, если водитель только что добавил воду. Нужно подождать некоторое время, чтобы свежая вода успела смешаться с существующим раствором. Перед тем как поднять плотность электролита, нужно помнить: чем больше концентрация серной кислоты, тем плотнее становится электролит.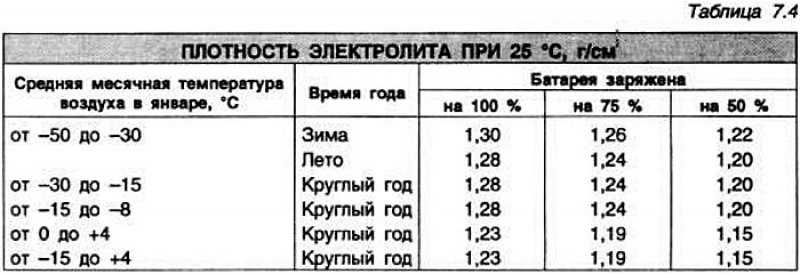 Чем выше плотность, тем выше уровень заряда.
Чем выше плотность, тем выше уровень заряда.
Для раствора электролита наилучшим выбором является дистиллированная вода. Это минимизирует возможные загрязнения в растворе. Некоторые загрязняющие вещества могут вызывать реакцию с ионами электролита. Например, если смешивать раствор с солями NaCl, получится осадок, что изменит качество раствора.
Влияние температуры на емкость
Какая плотность электролита — это будет зависеть от температуры внутри батарей. Руководство пользователя для конкретных батарей уточняет, какая коррекция должна применяться. Например, в руководстве Surrette/Rolls для температур в диапазоне от -17,8 до -54,4оC при температуре ниже 21оC, снимается 0,04 для каждых 6 градусов.
Многие инверторы или контроллеры заряда имеют датчик температуры батареи, который прикрепляется к аккумулятору. У них обычно есть ЖК-дисплей. Указание инфракрасного термометра также даст необходимую информацию.
Прибор для измерения плотности
Ареометр плотности электролита используется для измерения удельного веса раствора электролита в каждой ячейке. Кислотная аккумуляторная батарея полностью заряжена с удельным весом 1,255 г/см3 при 26оС. Удельный вес — это измерение жидкости, которая сравнивается с базовой. Это вода, которой присваивается базовое число 1.000 г/см3.
Кислотная аккумуляторная батарея полностью заряжена с удельным весом 1,255 г/см3 при 26оС. Удельный вес — это измерение жидкости, которая сравнивается с базовой. Это вода, которой присваивается базовое число 1.000 г/см3.
Концентрация серной кислоты в воде в новой аккумуляторной батарее составляет 1.280 г/см3, это означает, что электролит весит в 1.280 г/см3 раз больше веса того же объема воды. Полностью заряженная батарея будет тестироваться на уровне до 1.280 г/см3, в то время как разряженная будет учитываться в диапазоне от 1.100 г/см3.
Процедура проверки ареометром
Температура считывания ареометра должна быть скорректирована до температуры 27оC, особенно в отношении плотности электролита зимой. Высококачественные ареометры оснащены внутренним термометром, который будет измерять температуру электролита, и включают шкалу преобразования для коррекции показаний поплавка. Важно признать, что температура значительно отличается от показателей окружающей среды, если автомобиль эксплуатируется. Порядок измерения:
Порядок измерения:
- Несколько раз набрать резиновой грушей электролит в ареометр, чтобы термометр мог отрегулировать температуру электролита и замерить показания.
- Изучить цвет электролита. Коричневая или серая окраска указывает на проблему с батареей и является признаком того, что она приближается к концу своего срока службы.
- Набрать минимальное количество электролита в ареометр, чтобы поплавок свободно плавал без контакта с верхней или нижней частью измерительного цилиндра.
- Удерживать ареометр в вертикальном положении на уровне глаз и обратить внимание на показания, где электролит соответствует шкале на поплавке.
- Добавить или вычесть 0,004 доли единицы для показаний на каждые 6оC, при температуре электролита выше или ниже 27оC.
- Отрегулировать показания, например, если удельный вес 1.250 г/см3, а температура электролита составляет 32оC, значение 1.250 г/см3 дает скорректированное значение 1.
 254 г/см3. Аналогично, если температура составляла 21оC, вычесть значение 1.246 г/см3. Четыре балла (0.004) от 1.250 г/см3.
254 г/см3. Аналогично, если температура составляла 21оC, вычесть значение 1.246 г/см3. Четыре балла (0.004) от 1.250 г/см3. - Протестировать каждую ячейку и отметить показания, скорректированные до 27оC, перед тем как проверить плотность электролита.
Примеры измерения заряда
Пример 1:
- Показания ареометра — 1.333 г/см3.
- Температура 17 градусов, что на 10 градусов ниже рекомендуемого.
- Вычитаем 0,007 с 1,333 г/см3.
- Результат равен 1.263 г/см3, поэтому состояние заряда составляет около 100 процентов.
Пример 2:
- Данные плотности — 1,178 г/см3.
- Температура электролита — 43 градусов С, что на 16 градусов больше нормы.
- Добавляем 0,016 до 1,178 г/см3.
- Результат равен 1,194 г/см3, зарядка 50 процентов.
СОСТОЯНИЕ ЗАРЯДА | УДЕЛЬНЫЙ ВЕС г / см3 |
100% | 1,265 |
75% | 1,225 |
50% | 1,190 |
25% | 1,155 |
0% | 1,120 |
Таблица плотности электролита
Нижеследующая таблица температурной коррекции является одним из способов объяснить резкие изменения значений плотности электролита при различных температурах.
Чтобы использовать эту таблицу, нужно знать температуру электролита. Если измерение по каким-то причинам невозможно, то лучше использовать температуру окружающего воздуха.
Таблица плотности электролита приводится ниже. Это данные в зависимости от температуры:
| % | 100 | 75 | 50 | 25 | 0 |
| -18 | 1,297 | 1,257 | 1,222 | 1,187 | 1,152 |
| -12 | 1,293 | 1,253 | 1,218 | 1,183 | 1,148 |
| -6 | 1,289 | 1,249 | 1,214 | 1,179 | 1,144 |
| -1 | 1,285 | 1,245 | 1,21 | 1,175 | 1,14 |
| 4 | 1,281 | 1,241 | 1,206 | 1,171 | 1,136 |
| 10 | 1,277 | 1,237 | 1,202 | 1,167 | 1,132 |
| 16 | 1,273 | 1,233 | 1,198 | 1,163 | 1,128 |
| 22 | 1,269 | 1,229 | 1,194 | 1,159 | 1,124 |
| 27 | 1,265 | 1,225 | 1,19 | 1,155 | 1,12 |
| 32 | 1,261 | 1,221 | 1,186 | 1,151 | 1,116 |
| 38 | 1,257 | 1,217 | 1,182 | 1,147 | 1,112 |
| 43 | 1,253 | 1,213 | 1,178 | 1,143 | 1,108 |
| 49 | 1,249 | 1,209 | 1,174 | 1,139 | 1,104 |
| 54 | 1,245 | 1,205 | 1,17 | 1,135 | 1,1 |
Как видно из этой таблицы, плотность электролита в аккумуляторе зимой намного выше, чем в теплое время года.
Техническое обслуживание аккумуляторной батареи
Эти батареи содержат серную кислоту. При работе с ними всегда нужно использовать защитные очки и резиновые перчатки.
Если ячейки перегружены, физические свойства сульфата свинца постепенно изменяются, и они разрушаются, из-за чего нарушается процесс зарядки. Следовательно, плотность электролита уменьшается из-за низкой скорости химической реакции.
Качество серной кислоты должно быть высоким. В противном случае батарея может быстро стать неработоспособной. Низкий уровень электролита помогает высушить внутренние пластины устройства, после чего будет невозможно восстановить аккумулятор.
Сульфированные батареи можно легко распознать, просмотрев измененный цвет пластин. Цвет сульфатированной пластины становится светлее, а его поверхность становится желтой. Такие ячейки и демонстрируют снижение мощности. Если сульфирование происходит в течение длительного времени, наступают необратимые процессы.
Чтобы избежать этой ситуации, рекомендуется заряжать свинцово-кислотные аккумуляторные батареи в течение длительного времени при низкой скорости зарядного тока.
Всегда существует высокая вероятность повреждения клеммных колодок батарейных ячеек. Коррозия в основном поражает болтовые соединение между ячейками. Этого можно легко избежать, если обеспечить герметичность каждого болта с покрытием тонким слоем специальной смазки.
Во время зарядки аккумулятора существует высокая вероятность кислотного распыления и газов. Они могут загрязнять атмосферу вокруг батареи. Следовательно, около батарейного отсека нужна хорошая вентиляция.
Эти газы взрывоопасны, следовательно, открытое пламя не должно попадать внутрь пространства, где заряжаются свинцовые аккумуляторы.
Чтобы предотвратить взрыв батареи, который может привести к серьезным травмам или смерти, нельзя вставлять металлический термометр в аккумулятор. Нужно использовать ареометр со встроенным термометром, который предназначен для тестирования батарей.
Срок службы источника тока
Производительность батареи ухудшается с течением времени, независимо от того, используется она или нет, она также ухудшается при частых циклах заряда-разряда. Срок службы — это время, когда неактивная батарея может быть сохранена до того, как она станет непригодной для применения. Обычно считается, что это около 80% от ее первоначальной емкости.
Срок службы — это время, когда неактивная батарея может быть сохранена до того, как она станет непригодной для применения. Обычно считается, что это около 80% от ее первоначальной емкости.
Существует несколько факторов, которые существенно влияют на срок службы батареи:
- Циклическая жизнь. Время автономной работы определяется в основном циклами использования батареи. Обычно срок службы от 300 до 700 циклов при нормальном использовании.
- Эффект глубины разряда (DOD). Отказ от более высокой производительности приведет к сокращению жизненного цикла.
- Температурный эффект. Это является основным фактором производительности батареи, срока годности, зарядки и контроля напряжения. При более высоких температурах в батарее происходит большая химическая активность, чем при более низких температурах. Для большинства батарей рекомендуется использовать температурный диапазон -17 до 35оС.
- Напряжение и скорость перезарядки. Все свинцово-кислотные батареи выделяют водород из отрицательной пластины и кислород из положительной во время зарядки.
 Аккумулятор может хранить только определенное количество электроэнергии. Как правило, батарея заряжается на 90% за 60% времени. А 10% оставшегося объема батареи заряжается около 40% общего времени.
Аккумулятор может хранить только определенное количество электроэнергии. Как правило, батарея заряжается на 90% за 60% времени. А 10% оставшегося объема батареи заряжается около 40% общего времени.
Хорошее время жизни батарей — от 500 до 1200 циклов. Фактический процесс старения приводит к постепенному снижению емкости. Когда ячейка достигает определенного срока службы, она не перестает работать внезапно, этот процесс растянут во времени, за ним нужно следить, чтобы своевременно подготовиться к замене аккумулятора.
Почему падает плотность электролита в аккумуляторе — что делать при низкой плотности электролита в АКБ после зарядки
Практически все владельцы автомобилей с классическими свинцово-кислотными АКБ через 3-5 лет эксплуатации сталкиваются падением его емкости. Прежде всего, это химический элемент питания, в котором проходят электрохимические реакции разложения одних веществ в другие и обратно. Это однозначно меняет плотность электролита в аккумуляторе. Почему она непостоянна и как ее нормализовать?
Почему она непостоянна и как ее нормализовать?
Химические реакции в АКБ
Плотность электролита в аккумуляторе должна быть всегда на едином и неизменном уровне. Это важное условие, при котором источник питания нормально работает и в полную мощность отдает свою накопленную энергию. Если она выходит за нормированные рамки, упала или поднялась выше максимальной точки, это опасно. Автомобильный аккумулятор уже не будет работать так, как ранее.
Напомним, что в составе аккумулятора содержится раствор. Он представляет собой ту самую активную среду, в которой происходят все электрохимические реакции при зарядке, разрядке и хранении. Раствор на 65% состоит из дистиллированной воды, и только на 35% объема в нем — серная кислота. Получаем концентрацию 1:2, и она должна сохраняться на протяжении всего срока службы.
Автомобильная батарея состоит из 6 банок. В каждой из них находятся электродные пары, состоящие из положительной и отрицательной пластин. Имеется окислитель и восстановитель, которые взаимодействуют через жидкую кислотную среду, называемую электролитом. Восстановителем является губчатый свинец. Он находится в виде пасты на отрицательных решетках. Окислителем является диоксид свинца. Во время реакции окисления происходит переход электронов от восстановителя к окислителю. Данная реакция протекает, когда замкнута цепь и образован путь наименьшего сопротивления, так как внутри батареи оно больше.
Восстановителем является губчатый свинец. Он находится в виде пасты на отрицательных решетках. Окислителем является диоксид свинца. Во время реакции окисления происходит переход электронов от восстановителя к окислителю. Данная реакция протекает, когда замкнута цепь и образован путь наименьшего сопротивления, так как внутри батареи оно больше.
Электролит — это плохой проводник тока, но через него хорошо перемещаются ионы от восстановителя к окислителю. Указанная ранее концентрация является оптимальной для достаточного количества заряженных частиц. На положительном электроде накапливаются положительные ионы Н+, на отрицательном — отрицательные SO42-. При разряде положительные ионы Pb2+ от восстановителя устремляются к положительному электроду. Когда происходит соединение положительных и отрицательных ионов, на обеих пластинах возникает сульфат свинца. Это белые кристаллы, которые являются диэлектриком.
Плотность электролита в аккумуляторе напрямую зависит от качества протекающих реакций. Если сульфат свинца все-таки образовался, то при зарядке он частично разрушается и оседает в виде осадка на дно корпуса. Концентрация активного вещества в растворе снижается и плотность падает.
Если сульфат свинца все-таки образовался, то при зарядке он частично разрушается и оседает в виде осадка на дно корпуса. Концентрация активного вещества в растворе снижается и плотность падает.
Причинные изменения плотности АКБ
Чтобы ответить на вопрос, почему упала плотность электролита в батарее авто, необходимо вникнуть в особенности химических процессов внутри корпуса. Наиболее частыми причинами являются:
- Недостаточный уровень раствора в банках. Нужно регулярно делать простейшую диагностику аккумуляторной батареи. Она заключается в банальной проверке уровня электролита в источнике. Существует таблица, по которой можно определить нужное количество жидкости, но в любом случае пластины должны быть полностью прикрыты.
- Во время зарядки происходит закипание электролита, что является весьма нездоровым явлением. Батарея гарантировано выйдет из строя, если не принять нужные меры. В результате кипения и даже просто реакции гидролиза происходит испарение воды, и концентрация кислоты увеличивается.
 Нужно срочно добавить дистиллят и разбавить ее.
Нужно срочно добавить дистиллят и разбавить ее. - Регулярно заниженный уровень заряда. Если на вашей машине батарея не заряжается полностью, вероятно, имеют место проблемы в цепях зарядки или генераторе. Он не выдает полную мощность. Из-за этого источник питания скоро выйдет из строя.
Что нужно делать для поддержания плотности на нужном уровне?
Чтобы плотность электролита не была пониженной, необходимо регулярно выполнять следующие действия:
- Контролировать величину заряда батареи и не допускать его занижение.
- Проверять уровень электролита — если он маленький, нужно долить дистиллят.
- Анализировать ток утечки в автомобиле и производить ремонт электрики в случае его превышения нормированного значения, более 80 мА.
Как поднять плотность электролита?
Чтобы убедиться, что плотность электролита в АКБ после зарядки или простоя действительно падает, нужно произвести несложный тест. Для этого потребуется специальный прибор — ареометр. По нему несложно определить показатель плотности, так как имеется шкала. При температуре окружающей среды 15-20 градусов она должна быть на уровне 1,24-1,26 г/см3. Вероятно, она будет пониженной, и в таком случае ее нужно повышать. Выполнить это можно несколькими способами:
По нему несложно определить показатель плотности, так как имеется шкала. При температуре окружающей среды 15-20 градусов она должна быть на уровне 1,24-1,26 г/см3. Вероятно, она будет пониженной, и в таком случае ее нужно повышать. Выполнить это можно несколькими способами:
- Слить весь электролит и залить новый готовый до нужного уровня в каждой из банок. Жидкость свободно продается на автомобильных рынках.
- Добавить серную кислоту в недостающей концентрации. Необходимо измерить плотность в каждой банке, учесть недостающий объем и пропорционально добавить в каждую банку нужное количество активного вещества.
Важно. Чтобы слить кислоту из аккумулятора, нужно использовать приспособление для отсасывания жидкости. Переворачивать АКБ нельзя, потому что частица сульфата свинца, образовавшаяся на платине, может замкнуть банку.
Нормальный уровень электролита находится на 15 мм над пластинами. Измерить можно деревянной палочкой, опустив ее по очереди в каждую банку. Нельзя переливать и не доливать жидкость, потому что обе эти ситуации опасны и могут привести к порче батареи. Повышение плотности раствора нужно выполнять аккуратно, чтобы не нарушить другие смежные процессы.
Нельзя переливать и не доливать жидкость, потому что обе эти ситуации опасны и могут привести к порче батареи. Повышение плотности раствора нужно выполнять аккуратно, чтобы не нарушить другие смежные процессы.
Сохраните эту статью в популярных соц. сетях:
Работа ареометром и плотномером с электролитом аккумулятора >
Как выровнять плотность электролита в банках аккумулятора? если не охота покупать новый
Практически любой водитель сталкивается с такой проблемой, как быстрый разряд батареи при запуске двигателя или постоянная нехватка рабочего тока для работы стартера. Есть несколько причин, почему это происходит. Однако большинство из них связано с плотностью электролита.
В этой статье мы расскажем, как поднять плотность в аккумуляторе зарядным устройством, а также дадим пару других рекомендаций по эксплуатации аккумуляторных батареи.
Принцип работы автомобильного аккумулятораОсновной функцией аккумулятора автомобиля, по сути, является накапливание и хранение электрической энергии, которая протекает с помощью химической реакции, путем взаимодействия электролита и свинцовых пластин. Именно благодаря этим процессам вы и получаете полноценный автономный источник питания. От состояния вашего АКБ зависит не только успешность запуска двигателя, но и работа других автономных систем автомобиля.
Именно благодаря этим процессам вы и получаете полноценный автономный источник питания. От состояния вашего АКБ зависит не только успешность запуска двигателя, но и работа других автономных систем автомобиля.
Каждая батарея имеет свой определенный ток для холодного пуска двигателя.
Он бывает разным, поэтому аккумулятор подбирается для каждого двигателя индивидуально, например, для дизеля с объемом 2500 минимальный пусковой ток должен быть не меньше 600-650 ампер, но лучше все же использовать 750 А.
А количество времени, на протяжении которого батарея под нагрузкой может крутить стартер — называется емкостью аккумулятора. Измеряется этот показатель в А/ч.
Но все же принцип работы и неисправности у всех батарей одинаковые.
Принцип действия прост: в пластиковом корпусе запаяны свинцовые пластины, а пространство между ними заполнено раствором серной кислоты строго определенной плотности.
Концентрация кислоты напрямую связана с плотностью, чем ее больше, тем плотность выше. Второй составной частью является дистиллированная вода (полностью очищенная от посторонних примесей).
Второй составной частью является дистиллированная вода (полностью очищенная от посторонних примесей).
Итак, при появлении первых признаков неисправностей, первое, на что мы обращаем внимание — это плотность электролита. Рабочая плотность в стартерных батареях должна быть около 1,24 — 1,30 г/см³.
Замерять ее нужно специальным прибором — ареометром.
При разрядке аккумулятора плотность электролита снижается, а при зарядке – увеличивается, поэтому замерять плотность следует только на полностью заряженной батарее.
Помните, что при сильном повышении температуры плотность электролита может падать, поэтому замер лучше всего проводить после 10 часов стоянки.
Из-за разного рода неисправностей в автомобиле плотность аккумулятора может уменьшиться. Также причиной снижения плотности может быть глубокий разряд АКБ и его долгий срок хранения без подзарядки.
Если не устранить неполадки электросистемы автомобиля и долгое время не заряжать аккумулятор, то постоянная нехватка заряда приведет к появлению такого процесса, который называют сульфатацией. Именно он и вызывает преждевременное старение батареи.
Именно он и вызывает преждевременное старение батареи.
Чтобы этого избежать следует придерживаться некоторых рекомендаций по эксплуатации АКБ, которые описаны ниже в нашей статье.
Как поднять плотность в аккумуляторе зарядным устройством?Если нет дефектов пластин или при малом выпадении кристаллов свинца можно попробовать простой, но действенный метод, подняв плотность в аккумуляторе зарядным устройством. Для этого следует полностью зарядить батарею малым током.
После этого оставить на 10-12 часов отстояться и снова зарядить до полной зарядки аккумулятора. При этом напряжение следует выбрать около 14,6 — 14,8 В, а ток не более 1 — 2 Ампер.
Однако этот метод подходит только в том случае, если нет явных признаков неполадки аккумулятора.
Обратите внимание
Еще одним важным условием является соблюдение определенного уровня жидкости. Дело в том, что в процессе эксплуатации в каждой секции АКБ должно быть определенное количество раствора.
При повышенных температурах, которые возникают из-за нагрузок в процессе работы аккумулятора, вода может испаряться. Вследствие чего концентрация кислоты в электролите увеличивается.
А это в свою очередь также ведет к сульфатации пластин, тем самым снижая емкость аккумулятора, сокращает его срок службы.
Постоянная нехватка нужного уровня электролита приводит к преждевременному старению и потере емкости аккумулятора, поэтому уровень жидкости нужно контролировать. Для глубокого смешивания раствора после доливки жидкости необходимо через некоторое время снова зарядить аккумулятор.
Для зарядки можно применять реле времени, которое автоматически отключает зарядное устройство через заданное время. Подключив реле, следует настроить его на автоматическое отключение через 15 минут. Вслед за тем делаем перерыв 15 минут и снова включаем зарядное устройство. И так до полного набора емкости АКБ.
Вслед за тем делаем перерыв 15 минут и снова включаем зарядное устройство. И так до полного набора емкости АКБ.
Смотрим полезное видео, как восстановить свинцовый аккумулятор зарядным устройством:
Сейчас появились интеллектуальные зарядки, которые в зависимости от уровня разряда сами выбирают напряжение и ток. Такие зарядки способствуют реактивации и восстановлению аккумулятора.
Помните, что проверять плотность электролита следует только на полностью заряженной батарее. А долив дистиллированной воды следует производить лишь через некоторое время после поездки.
Дело в том, что повышенная температура электролита может также влиять на объем жидкости в аккумуляторе. Такую реакцию еще называют температурным расширением. Что позволит вам не ошибиться с уровнем электролита.
Так как при переизбытке жидкости в батареи электролит может вытекать через отверстия в пробках, что приводит к повышенной утечке тока аккумулятора.
Рекомендации по продлению срока службы аккумулятораЧтобы не потерять дорогостоящую АКБ раньше срока нужно придерживаться следующих рекомендаций:
- Систематически проверять напряжение на генераторе;
- Время от времени следует полностью заряжать АКБ, так как редкая короткая подзарядка не дает возможности глубокому перемешиванию электролита и приводит к появлению кристаллов свинца на пластинах;
- Не допускается длительное хранение незаряженной батареи;
- Доливайте только воду, чтобы не превысить плотность электролита;
- Чаще следите за уровнем жидкости.

Помните, что соблюдение простых правил по уходу поможет сохранить вам дорогостоящий источник питания. А периодическая полная зарядка аккумулятора зарядным устройством поможет сохранить его в полной работоспособности.
Это все что мы хотели сказать по данному вопросу, теперь вы знаете, как поднять плотность в аккумуляторе зарядным устройством. Надеемся, что данный материал оказался для вас полезным. Чаще следите за состоянием вашего аккумулятора, и он прослужит вам долгую службу!
Источник: https://auto-pos.ru/125-kak-podnyat-plotnost-v-akkumulyatore-zaryadnym-ustrojstvom.html
Выровнял плотность электролита во всех банках аккумулятора — Renault Duster, 2.0 л., 2013 года на DRIVE2
В продолжение предыдущей записи про доливку дистиллированной водички в аккум, после двух лет эксплуатации без обслуживания.После доливки до MAX дистиллированной водички в каждую банку (влезло 0,5 л на все 6 банок) и зарядки автоматическим зарядным устройством, током от 2 А до 0,5 А в течении 20 часов, по истечении суток эксплуатации замерил плотность электролита в банках.
- Оказалось, что в средних четырех банках плотность одинаковая — 1,27, а в двух крайних банках (слева и справа) она чувствительно меньше — 1,23; 1,24.
Погуглив, почитав различные статьи по предмету выяснил, что как бы это не конец, но позаботиться о продлении жизни аккуму неплохо бы :)Если зарядка не помогла выровнять плотность электролита, необходимо выровнять при помощи концентрированного электролита плотностью 1,4.Ринулся по магазинам торгующими аккумуляторами и автомагазинам по пути следования.
К моему удивлению, концентрированного электролита нигде не было в наличии.В одном из магзиков консультант поделился, что плотность 1,4 запрещена и не выпускается уже давненько, а стандартный корректирующий электролит плотностью 1,33, не привозили уже месяца три, в связи с какими-то предстоящими изменениями в законодательстве и скорее всего корректирующий будет еще меньшей плотности.
Правда или нет, но за что купил, за то и продаю 🙂
- Доехал до авторынка, где есть множество мелких магазинчиков-палаток и в одном из них без проблем нашлась литрушка корректирующего электролита 1,33, всего за 70 руб 🙂
Итак, чего и сколько отливать/доливать…Статьи в инете в основном старинные, т. к. аккумулятор давно уже перешел в разряд расходников и обслуживать его стремятся немногие.
к. аккумулятор давно уже перешел в разряд расходников и обслуживать его стремятся немногие.
За основу для расчетов взята статья с сайта — Автоэлектроника: Простенько и со вкусом
Суть корректировки плотности электролита в банке аккумулятора заключается в следующем:а) из банки забирается некоторый объём электролита;б) вместо него в банку добавляется тот-же объём либо дистиллированной воды (плотность 1,00) — для понижения плотности электролита в банке, либо корректирующего электролита (обычно плотностью 1,40) — для повышения плотности;Равенство объёмов забираемой и добавляемой жидкостей используется только для упрощения всей процедуры и более простого логического осмысления её результатов.По мере приобретения опыта, указанное равенство может нарушаться.
в) батарея включается на 30 минут на заряд номинальным током для лучшего перемешивания электролита в результате газовыделения;
г) батарея отключается от зарядного устройства и выдерживается 0,5÷2 часа для выравнивания плотности электролита в объёме банок;д) измеряется плотность электролита в каждой банке и его уровень, оба параметра приводятся в норму. Т.е. при необходимости, все операции а) и д) повторяютсяНиже приведена формула, при использовании которой можно применять корректирующий электролит с плотностью отличной от 1,40
Т.е. при необходимости, все операции а) и д) повторяютсяНиже приведена формула, при использовании которой можно применять корректирующий электролит с плотностью отличной от 1,40
где:Vэ — объём удаляемого из банки электролита, см3,Vб — объём электролита в одной банке, см3,ρн — начальная плотность электролита до корректировки, г/см3,ρк — конечная плотность, которую надо получить, г/см3,ρд — плотность доливаемой жидкости, (вода — 1,00 г/см3 или корректирующий электролит — * г/см3)Следует учесть, что при использовании данной формулы объёмы удаляемого и добавляемого электролитов равны.
Итак, теперь главный вопрос, какой объем электролита в нашем ISTA CALCIUM 12V 70A/h?На него ответа так и не нашел, но решено по аналогии с размерами наших русских аккумов, взять за исходник объем в 6СТ-55 (60) — 3,8 л.
По итогу вышло, что вероятно в нашем аккуме примерно 3,5 л.По расчетам при плотности начальной 1,24, необходимо заместить на корректирующий электролит 1,33, примерно 211 см3.
Чтобы сильно не ошибиться, для начала из каждой крайней банки изъято четыре раза по 40 единиц объема указанного на колбе ареометра, итого 160 из каждой 🙂
- Соответственно столько же и залито электролита 1,33
После перемешивания, перебулькивания 🙂 плотность как раз оказалась 1,27Оставляю заряжаться на 10 ч током от 2 до 0,5 А (автоматическое зарядное) и утром плотность оказывается практически 1,32 в каждой банке.Многовато, но это только сразу после отключения зарядки.
Через пару дней проверяю, в каждой банке ровно 1,30, во всех шести.Повторяю процедуру с замещением небольших объемов в кажой банке на дистиллированную воду.В этот раз из каждой банки забрал по 60 см3, взамен заливаю дистиллировку.Полчаса подзарядил, покатался денек и на проверку.
Ну вот теперь около дела, во всех банках плотность электролита одинакова — 1,26
- для стремительно надвигающегося лета в самый раз 🙂
Если все эти манипуляции помогут продлить жизнь аккуму еще года на три, то в принципе не напрягает. Да и когда знаешь, что мерять и доливать, то совсем все просто.
Да и когда знаешь, что мерять и доливать, то совсем все просто.
Следующая проверка состояния в октябре/ноябре 🙂
PS: прошло более полутора лет с момента данной операции с корректирующим электролитом и уже после этого читал много мнений, что нельзя так корректировать плотность, правильный вариант только полной зарядкой аккума стационарным зарядником, что в итоге после полной зарядки получится перекос по плотности в банках… НО, буквально на днях заморочился полной зарядкой аккума в несколько этапов и в итоге в этих крайних банках плотность по окончанию заряда как и в остальных — 1,27 все норм.В этот раз подвела только одна банка в середине, во всех 1,27, а в одной 1,25 после полной зарядки.
КТЦ для аккума проведены, полный заряд произведен, думаю терять нечего, с одной средней банкой повторю экзекуцию с корректирующим электролитом
Цена вопроса: 70 ₽ Пробег: 32400 км
Источник: https://www.drive2.ru/l/6151660/
Как поднимать плотность электролита в аккумуляторе в домашних условиях
Доброго времени суток! Все читатели блога знают, что обслуживаемый аккумулятор, требует периодических проверок. Ведь концентрация серной кислоты в нем со временем падает. Поэтому, каждый уважающий себя автомобилист, должен знать, как поднять плотность электролита в аккумуляторе. Об этом, мы с вами и поговорим.
Ведь концентрация серной кислоты в нем со временем падает. Поэтому, каждый уважающий себя автомобилист, должен знать, как поднять плотность электролита в аккумуляторе. Об этом, мы с вами и поговорим.
Содержание
Почему плотность электролита падает
Прежде чем разбираться, как повысить плотность электролита в аккумуляторе, давайте выясним причины ее падения.
Для любого АКБ, изменение плотности это нормальное явление. Т.е., аккумулятор разрядился – ее значение понизилось. Зарядился – повысилось. Но в некоторых ситуациях, батарея попросту не держит заряд. А это говорит о том, что концентрация упала слишком сильно и ее пора поднимать.
Почему у АКБ становится маленькая плотность:
- аккумулятор просто разряжен;
- батарея подвергалась перезарядке, в результате чего выкипал электролит;
- в банки доливается дистиллированная вода, а замеры концентрации не проводятся. В результате плотность электролита постепенно падает;
Кстати, если АКБ будет долго работать в таком состоянии, это приведет к сульфитации пластин. Поэтому, лучше его не запускать.
Поэтому, лучше его не запускать.
Подготовка
Итак, если в результате проверки ареометром, обнаружилась низкая плотность электролита в аккумуляторе ее нужно поднимать. Но, прежде чем это делать, нужно убедиться, что соблюдены некоторые условия:
- АКБ заряжен;
- температура электролита в банках находится в пределах 20-25 оС;
- во всех банках уровень жидкости в норме;
- аккумулятор целый. На АКБ, часто появляются трещины возле токовыводов, из-за расшатывания контактов. Поэтому не нужно стучать и прикладывать излишних усилий чтобы снять клемму на аккумуляторе. Лучше потратить немного больше времени и сделать это аккуратно.
Если же батарея автомобиля разряжена, то она заряжается, а после измеряется плотность. Почему так? Дело в том, что при низком заряде – концентрация кислоты в банках уменьшается.
Если залить корректирующий раствор в незаряженный аккумулятор – концентрацию серной кислоты можно повысить до такой степени, что в банках осыпятся пластины.
Нужно учесть, и тот факт, что автомобильный генератор, заряжает аккумулятор лишь на 85-90%. Поэтому перед замерами, зарядку батареи нужно проводить в обязательном порядке.
Корректирующая подзарядка АКБ
Иногда, может возникнуть ситуация, что после полной зарядки, плотность электролита в банках оказывается разная. Вообще, разница в плотности допускается не более 0,01 кг/см3. Иначе, требуется ее выравнивание.
Для этого, можно провести корректирующую подзарядку батареи. В 2-3 раза уменьшается сила тока (по сравнению с номинальной величиной) и АКБ заряжается 1-2 часа. Если это не помогло выровнять плотность электролита – потребуются более радикальные меры.
Корректирующий электролит
Корректирующим, называют электролит с плотностью 1,40 кг/см3. Запомните, ни в коем случае, нельзя просто так вливать его в АКБ. Т.е. вначале, нужно проверить аккумулятор и выяснить причину падения уровня жидкости, а потом его уже поднимать.
Часто встречается ситуация, когда начинающие автолюбители неправильно истолковывают название «корректирующий». Например, когда из банок выпарилась вода. Т.е. нужно поднять уровень жидкости, а тут как раз корректирующий раствор. Логика проста:
Например, когда из банок выпарилась вода. Т.е. нужно поднять уровень жидкости, а тут как раз корректирующий раствор. Логика проста:
- в АКБ залит электролит, а его уровень упал;
- раствор корректирующий, значит он предназначен для корректировки уровня жидкости.
К сожалению, такая точка зрения в корне неправильна. В большинстве случаев, для выравнивания уровня, в АКБ льется дистиллированная вода.
А корректирующий электролит льется в таких случаях:
- если жидкость вытекла из банок;
- если вы налили в АКБ слишком много дистиллята и понизили плотность.
Поэтому не нужно его лить, если, например, батарея просто разряжена, а соответственно концентрация ниже требуемой.
Поднимаем плотность электролита в АКБ
Итак, давайте разбираться, как повысить плотность аккумулятора. Скажу сразу – дело это хоть и не хитрое, но достаточно кропотливое и к тому же, занимает много времени. Поэтому лучше заранее запастись терпением.
Нормальная плотность электролита должна быть в пределах 1,25-1,27 г/см3. Причем, это значение должно быть одинаково для всех банок. Для того чтобы поднять концентрацию электролита в банках аккумулятора, используется корректирующий раствор. Если же вы захотите самостоятельно приготовить смесь в домашних условиях, запомните последовательность:
- в емкость льется дистиллят, а уже в него добавляется серная кислота. Если сделать наоборот – раствор начнет бурно кипеть.
Кроме того, понадобится:
- аэрометр с грушей для откачки жидкости из банок;
- стеклянная емкость для слива старого электролита;
- мерный стакан;
- защитные очки, перчатки.
Важно помнить и то, что у жидкости может быть разная плотность в банках. Поэтому имеет смысл сделать простую табличку, куда заносить результаты замеров по каждой банке – иначе можно запутаться.
Сразу сделаю одно важное уточнение. Некоторые товарищи, советуя как поднять плотность в аккумуляторе, предлагают полностью выливать электролит и заливать новый. А для этого, они рекомендуют просто перевернуть батарею, вылить жидкость и промыть все дистиллированной водой. А в результате таких манипуляций перестает работать одна или несколько банок.
А для этого, они рекомендуют просто перевернуть батарею, вылить жидкость и промыть все дистиллированной водой. А в результате таких манипуляций перестает работать одна или несколько банок.
Почему так происходит? Дело в том, что на дне собирается свинцовый осадок. И если АКБ перевернуть – кусочки свинца могут упасть между пластин и закоротить их. Т.е. банка перестает работать.
Итак, когда упала плотность электролита, есть несколько действенных метода, чтобы ее безболезненно поднять. Давайте их рассмотрим.
Доливка корректирующего электролита
Для этого понадобится концентрированный электролит.
Как увеличить плотность:
- из банки откачивается жидкость при помощи аэрометра или обычной спринцовки;
- вместо нее, заливается такой же объем корректирующего раствора;
- АКБ ставится на зарядку на полчаса – час, после чего, выдерживается в течение 2-3 часов;
- проводятся контрольные замеры;
- при необходимости, процедура повторяется.

При откачке, нужно следить, чтобы не оголялась поверхность пластин.
Выравнивание при помощи зарядного устройства
Здесь все просто. Единственное условие, понадобится зарядное для автомобиля с жесткой регулировкой выходного напряжения. Автоматические зарядные, уменьшающие силу тока при достижении полной зарядки не подойдут.
Как восстановить плотность:
- АКБ доводится до полной зарядки;
- когда он заряжен и начинает кипеть – уменьшается сила тока до 1-2 Ампер;
- логика простая – АКБ кипит, вода испаряется, концентрация электролита повышается;
- время выпаривания зависит от конкретного случая и может длиться больше суток;
- когда уровень упал – доливается электролит и замеряется плотность;
- если нужно – операция повторяется.
Из минусов, стоит отметить, что это долго.
Если плотность слишком низкая
Как выровнять плотность, если она слишком низкая? Например, если ее значение, ниже 1,18, описанные методы не сработают. Придется сливать кислоту полностью.
Придется сливать кислоту полностью.
Давайте разберемся, что делать в этом случае:
- электролит откачивается из банок, насколько это возможно;
- АКБ аккуратно переворачивается, и в дне высверливаются отверстия в каждой банке.
- Желательно делать это в какой-нибудь емкости, например в тазу;
- после этого, батарея ставится в вертикальное положение, и с нее выливаются остатки жидкости;
- аккумулятор промывается дистиллированной водой;
- отверстия запаиваются, и заливается новый раствор.
Пластик для запаивания дырок, должен быть устойчивым к серной кислоте.
Иногда встречаются ситуации, когда в старых аккумуляторах совсем нет плотности. Это говорит о глубокой сульфатации. В этом случае потребуются более серьезные меры для восстановления.
На самом деле, если в вашем аккумуляторе упала плотность электролита – это не такая уж большая проблема. И поднять ее можно без особых трудов. Но, лишь в том случае, если определить падение концентрации вовремя. Если же за аккумулятором не следить – он просто выйдет из строя.
Если же за аккумулятором не следить – он просто выйдет из строя.
С уважением, Максим Марков!
Источник: http://carsmotion.ru/prakticheskie-sovety/kak-podnyat-plotnost-ehlektrolita-v-akkumulyatore.html
Почему падает плотность электролита в аккумуляторе
Раствор электролита является катализатором электрохимической реакции, благодаря которой аккумуляторная батарея работает. Он на 65% состоит из дистиллированной воды, а оставшиеся 35% составляет кислота.
Чтобы реакция протекала с необходимой скоростью, электролит должен обладать определенной концентрацией.
Разобравшись с причиной, почему падает плотность электролита в аккумуляторе, можно восстановить работу АКБ.
Причины падения показателя
Перед тем как увеличить плотность в аккумуляторе, необходимо разобраться в причинах происходящего. Для любой аккумуляторной батареи изменение этого параметра считается нормальным явлением. Когда АКБ разряжается, то он падает и наоборот.
Если же после зарядки аккумулятор не способен удерживать заряд, то плотность электролита упала ниже минимально допустимого уровня.
Причин, почему падает плотность в аккумуляторе, может быть несколько:
- Батарея просто разряжена.
- Из-за перезаряда АКБ часть раствора выкипела.
- Вода была долита, но концентрация раствора не контролировалась.
С первым пунктом все предельно ясно, и дополнительных комментариев здесь не требуется. А вот причины кипения раствора известны далеко не каждому автовладельцу. Следует заметить, что этот процесс в сравнении с кипением воды имеет иную природу. Во втором случае он активируется благодаря нагреванию емкости. Вполне очевидно, что аккумулятор никто не подогревает, но при этом электролит кипит.
Причина этого в физически-химических процессах, протекающих в АКБ. Если она отключена от бортовой электросети или зарядного устройства, то электролит не будет кипеть. Под воздействием электрического тока в растворе активируется процесс электролиза, а молекулы воды распадаются на водород и кислород. Именно эти газы и поднимаются в виде пузырьков.
Многим автолюбителям, особенно начинающим, известна ситуация: долил воды в аккумулятор — пропала плотность. Во время технического обслуживания батареи необходимо в обязательном порядке контролировать этот показатель. В противном случае концентрация раствора будет постепенно снижаться.
Подготовка батареи
Когда автолюбителю известно, почему упала плотность электролита в аккумуляторе, то сразу поднимать ее не стоит. Необходимо провести некоторые подготовительные мероприятия. Для этого следует убедиться в выполнении нескольких условий:
- Батарея заряжена.
- Температура раствора в элементах питания составляет от 20 до 25 градусов.
- Уровень электролита в каждой банке соответствует норме.
- Аккумулятор не имеет механических повреждений.
Рекомендуем: Особенности и цена автомобильного аккумулятора Atlas BX
Если АКБ оказалась разряжена, сначала следует восстановить ее емкость. Затем в обязательном порядке проводится измерение плотности раствора, так как концентрация кислоты может быть ниже нормы.
Возможна ситуация, в которой этот параметр раствора после перезарядки в элементах питания отличается. Следует помнить, что допустимая разница этого показателя составляет максимум 0,01 кг/см3.
Для выравнивания значений плотности в банках необходимо провести корректирующую подзарядку. Делается это следующим образом:
- Сила тока уменьшается в 2−3 раза в сравнении с номинальным показателем.
- Батарея заряжается в течение 1−2 часов.
Если этот метод не помог решить проблему, придется предпринимать более серьезную меру, долив корректирующего электролитного раствора. Здесь необходимо заметить, что использовать его можно только в крайнем случае.
Корректирующим называется электролит, плотность которого составляет 1,4 кг/см3.
Сначала автолюбитель должен проверить АКБ и узнать, почему пропадает концентрация раствора. Если это произошло из-за кипения воды, то корректирующий электролит доливать нельзя. Используется он лишь в двух случаях:
- Обнаружена утечка жидкости из элементов питания.

- В банки было залито много дистиллированной воды, что и стало причиной снижения плотности раствора.
Восстановление плотности
Это кропотливый процесс и автолюбителю потребуется затратить довольно много времени. Причем решить поставленную задачу можно двумя способами и каждый из них необходимо рассмотреть. Начать стоит с доливания корректирующего электролита. Нормальной считается плотность раствора в диапазоне от 1,25 до 1,27 г/см3. Также следует помнить, что это значение должно быть одинаковым в каждом элементе питания батареи. Чтобы приготовить корректирующий электролит, в емкость следует первой залить дистиллированную воду и лишь затем добавить к ней кислоту. В противном случае будет наблюдаться сильное кипение жидкости.
Сначала необходимо из банки откачать раствор с помощью простой спринцовки либо аэрометра. Затем в элемент питания заливается аналогичное количество корректирующего электролита. После этого батарею необходимо поставить на зарядку. После завершения процесса проводится замер параметра и при необходимости процедура повторяется.
Рекомендуем: Автомобильные аккумуляторы Banner с австрийским качеством
Для реализации второго способа потребуется зарядное устройство. Однако оно должно предоставлять возможность тонко регулировать выходное напряжение. Автоматические зарядные устройства здесь использовать нельзя. Чтобы восстановить плотность, необходимо выполнить следующие действия:
- Полностью зарядить АКБ.
- Когда электролит закипит, силу тока необходимо снизить на 1−2 А.
- Время кипения жидкости зависит от конкретной ситуации и может достигать 24 часов.
После завершения процедуры проводится замер показателя плотности, и при необходимости процесс повторяется. Однако в некоторых ситуациях ни один из этих методов может не сработать.
Чаще всего это наблюдается при падении плотности до уровня 1,18 кг/см3 и ниже. В этом случае следует откачать максимальное количество раствора.
Затем батарея переворачивается, и в дне каждого элемента питания просверливаются отверстия.
Вернув АКБ в нормальное положение, остатки электролита выливаются. Банки промываются дистиллированной водой, а затем отверстия надежно запаиваются.
После всех этих манипуляций остается лишь залить новый электролит. Проблема падения плотности раствора не является сложной, и она может быть быстро устранена.
Однако важно своевременно обнаружить падение показателя, чтобы АКБ не вышла из строя раньше срока.
Источник: https://ProAkkym.ru/avto/padaet-plotnost-jelektrolita
Как увеличить плотность электролита в аккумуляторе
- Почему падает плотность электролита?
- Основные причины, по которым может упасть показатель уровня электролита в банках автомобильной аккумуляторной батареи (АКБ):
— Разряд устройства. Как правило, разряжение в аккумуляторе автомобиля происходит в холодное время года, поэтому зимой используют специальные методы, позволяющие восстановить и поднимать уровень заряда. Проблема может проявляться в автомобильном аккумуляторе, который близок к естественному износу. При быстром разряде можно сделать вывод о падении пропорции рабочего раствора до критически низкого уровня. Проблема разряжения может быть связана с механическим повреждением устройства или неисправностью генераторной установки, в результате чего электросеть автомобиля питается от АКБ.
При быстром разряде можно сделать вывод о падении пропорции рабочего раствора до критически низкого уровня. Проблема разряжения может быть связана с механическим повреждением устройства или неисправностью генераторной установки, в результате чего электросеть автомобиля питается от АКБ.
— Выкипание рабочей жидкости в результате перезарядки аккумулятора. Если на устройство поступает постоянное напряжение, это приводит к разделению воды на кислород и водород. В результате при зарядке жидкость выкипает и уровень электролита снижается.
— Постоянное добавление дистиллированной воды вместо химического раствора. Если долить жидкость единожды, то уровень плотности АКБ в машине упасть не должен, но постоянные доливания будут этому способствовать.
- Как подготовить аккумулятор к восстановлению?
- Перед тем, как восстановить на обслуживаемом аккумуляторе плотность электролита, необходимо выполнить ряд действий:
- — Производится демонтаж батареи с авто, для этого предварительно ослабляются клеммные зажимы устройства.

— При наличии защиты выполняется ее снятие. Для этого потребуется гаечный ключ соответствующего размера.
— С помощью отвертки или другого приспособления с плоским наконечником производится откручивание пробок на банках. Рекомендуется использовать защитные очки и перчатки, чтобы не допустить появления ожогов.
— Пользователь выполняет диагностику объема рабочей жидкости в устройстве. Для легковых транспортных средств данный параметр должен составить около 1,5 сантиметров выше пластин.
Диагностика плотности электролита должна производиться через 3 часа после подзарядки устройства либо примерно через 10 ч после остановки двигателя.
Если уровень жидкости соответствует норме, то ареометр опускается в банки и с помощью груши производится набор небольшого объема воды.
— В зависимости от температуры воздуха производится оценка полученных параметров. Проверка выполняется для каждой банки отдельно. В идеале данный показатель должен составить в диапазоне от 1. 25 до 1.29 г/см3.
25 до 1.29 г/см3.
Как самостоятельно увеличить плотность электролита?
Для правильного проведения процедуры необходимо учитывать следующие нюансы:
— При приготовлении нового рабочего раствора в дистиллированную воду добавляется кислота, а не наоборот. В противном случае начнется кипение жидкости.
- — Пользователю понадобятся точные расчеты нужного объема кислоты, так как в процессе заряда уровень плотности электролита увеличивается.
- Что понадобится?
- Чтобы правильно повысить плотность аккумуляторной батареи перед зимним периодом, нужно подготовить следующие материалы и инструменты:
- — ареометр;
- — мерный стакан или другая аналогичная емкость;
- — отдельная емкость для разведения нового рабочего раствора;
- — клизма-груша;
- — корректирующий раствор либо кислота;
- — дистиллированная вода.
- Пошаговая инструкция по повышению плотности электролита добавлением жидкости
- Правильный способ для увеличения параметра плотности электролита батареи:
— Перед тем, как в аккумуляторе поднять плотность, производится снятие аккумуляторной батареи с автомобиля. Для этого отключаются клеммные зажимы и производится демонтаж фиксирующей пластины. Действия по выполнению задачи осуществляются с применением гаечного ключа.
Для этого отключаются клеммные зажимы и производится демонтаж фиксирующей пластины. Действия по выполнению задачи осуществляются с применением гаечного ключа.
— С банки аккумуляторной батареи отбирается небольшой объем рабочего раствора. Для этого используется ареометр.
— Вместо изъятого объема жидкости в банку добавляется корректирующий раствор вещества при необходимости увеличения плотности. В случае, если требуется понизить этот параметр, используется дистиллированная вода с плотностью 1,00 г/см3.
— Затем аккумулятор ставится на подзарядку. На протяжении последующих 30 минут производится подзарядка устройства номинальным током. Такие действия позволят залитому корректирующему раствору смешаться с рабочей жидкостью.
— Аккумуляторная батарея отключается от зарядного прибора на один-два часа. Это позволит плотности в банках «выровняться» и снизиться уровню температуры. Также за два часа из банок выйдут все пузырьки, благодаря чему исключается вероятность погрешности при контрольном замере.
— Повторно производится диагностика уровня плотности электролита, при необходимости процедура повторяется заново. Также при необходимости в банки добавляется жидкость для увеличения или уменьшения параметра, а затем заново производится замер.
ВАЖНО ЗНАТЬ
Надо учитывать, что разница параметра плотности между банками должна составить не более 0,01 г/см3. Если при выполнении задачи не удалось достигнуть такого результата, то требуется выполнить дополнительную, «выравнивающую» зарядку на протяжении 1-2 часов. При этом параметр тока должен составить в 2-3 раза меньше номинального.
Как поднять зарядным устройством?
Для повышения плотности зарядным оборудованием выполняются следующие действия:
— Аккумуляторная батарея доводится до полной зарядки. Предварительно нужно снять устройство с автомобиля и подключиться к оборудованию, которое будет заряжать АКБ, с соблюдением полярности. Сначала выполняется соединение с прибором, а затем его подключение к сети.
— В процессе восстановления заряда пользователю нужно следить за состоянием электролита. После того, как жидкость начала кипеть, необходимо снизить параметр силы тока до 1-2 ампер. При кипении воды происходит ее испарение, это приводит к тому, что плотность концентрации электролита начинает повышаться.
- — Время испарения жидкости определяется конкретной ситуацией, в некоторых случаях на это может потребоваться более 24 часов.
- — После снижения уровня воды в банках производится добавление электролита и замер плотности.
- — При необходимости производится повторение данной операции.
- Как увеличить плотность, если она ниже 1,18
- Если рабочее значение плотности составил менее 1,18 г/см3, описанные способы не позволят решить проблему и пользователю потребуется полностью сливать кислоту из банок.
- Алгоритм действий при этом будет такой:
- — Электролит откачивается из аккумуляторной батареи, насколько это возможно (для откачки можно использовать грушу с клизмой).

— Аккумулятор осторожно переворачивается без резких движений. Это позволит предотвратить возможное осыпание пластин. В дне устройства надо просверлить отверстия в каждой банке с помощью дрели. Эти действия рекомендуется выполнять в емкости, к примеру, миске или тазике.
— Затем аккумулятор устанавливается в вертикальное положение и из него сливаются остатки рабочего раствора.
— Производится промывка батареи с помощью дистиллята.
— Отверстия в дне аккумулятора запаиваются, на этом этапе важно убедиться в герметичности устройства, чтобы не допустить дальнейшей утечки жидкости. Производится заливка нового раствора в батарею.
Источник — https://kodobd.top/podnyat-plo…
- Мотор
- Личный опыт
- Эксплуатация, советы
- Новости
Источник: https://cont.ws/post/1251806
Плотность электролита в аккумуляторе: как проверить и повысить
Плотность электролита в аккумуляторе является важнейшим параметром для кислотных АКБ. От плотности электролита напрямую зависит срок службы и общая работоспособность батареи, емкость аккумулятора, способность накапливать и удерживать с заряд, а также работать под нагрузкой.
От плотности электролита напрямую зависит срок службы и общая работоспособность батареи, емкость аккумулятора, способность накапливать и удерживать с заряд, а также работать под нагрузкой.
При этом в процессе эксплуатации плотность в аккумуляторе может меняться, что указывает на необходимость проверки. Далее мы рассмотрим, какая должна быть плотность электролита в аккумуляторе, как проверить плотность аккумулятора, а также как повысить плотность в аккумуляторе при такой необходимости в рамках обслуживания АКБ.
Какая плотность должна быть в аккумуляторе автомобиля
Итак, прежде чем рассматривать, какая должна быть плотность электролита и как правильно поднять плотность аккумулятора, важно понимать, что под самой такой плотностью следует понимать удельный вес кислоты в растворе, который залит в банки АКБ.
Прежде всего, проверка плотности является важным этапом в рамках обслуживания АКБ. Так вот, в свинцовых батареях плотность измеряется в граммах на см3. Показатель плотности пропорционален концентрации раствора, а также зависит от температуры. Чем сильнее нагрет раствор, тем меньшей будет плотность.
Чем сильнее нагрет раствор, тем меньшей будет плотность.
При этом плотность электролита указывает на то, в каком состоянии находится АКБ. Как правило, если аккумулятор теряет способность держать заряд, необходимо проверять уровень и состояние электролита в банках. Такая проверка осуществляется ареометром, при этом температура должна быть около 25 градусов Цельсия. Если температура другая, необходимо внести отдельные поправки (можно использовать таблицу).
Идем далее. В процессе эксплуатации АКБ важно, чтобы показатель плотности электролита соответствовали норме, причем с учетом климатических условий. Это значит, что плотность электролита зимой и летом отличается.
Важно
Если климат умеренный (нет большой жары и холода), плотность электролита должна быть 1.25-1.27 г/см3.
Если в регионе морозы больше -30, тогда значение повышают на 0,01 г/см3 больше, если же стоит сильная жара выше +30, тогда показатель уменьшают на 0,01 г/см3.
Если же морозы сильные (температура опускается до -50 °С), чтобы электролит в АКБ не замерз, в таком случае нужно повышать плотность электролита в аккумуляторе зимой до 1. 29 г/см3.
29 г/см3.
Для наглядности, таблица плотности электролита в аккумуляторе позволяет понять, какой должна быть плотность аккумулятора зимой или летом, в условиях сильной жары или холода, в умеренном климате и т.
д. При этом важно учитывать, что чем меньшей будет плотность, тем большим оказывается общий срок службы аккумулятора автомобиля. Это значит, что без необходимости повышать плотность не рекомендуется.
Еще нужно учитывать, что АКБ, установленная на машину, заряжена не на 100%, а на 85-90% от номинальной ёмкости. Это значит, что плотность электролита при замерах зачастую оказывается ниже по сравнению с полностью заряженной АКБ. По указанным выше причинам нужно выбрать значение, которое немного выше (на 0.01), чем приведено в таблице плотности. Такой подход будет означать, что аккумулятор не замерзнет зимой.
Однако если речь идет о лете, слишком высокая плотность может привести к закипанию электролита в АКБ. Важно соблюдать баланс, так как повышение плотности сокращает срок службы батареи, тогда как понижение приводит к снижению напряжения, аккумулятор хуже крутит стартер, быстрее разряжается и т. д.
д.
Еще добавим, что если зимой температура не падает ниже -30 и летом не повышается выше + 30, тогда изменять стандартное значение плотности аккумулятора не следует. Главное, следить, чтобы это значение постоянно сохранялось.
Плотность электролита в аккумуляторе зимой и летом
Итак, номинальная плотность электролита в аккумуляторе зимой составляет 1,27. Если температуры ниже -35, тогда плотность повышается до 1.28 г/см3. При этом дальнейшее увеличение плотности также не рекомендуется.
Если же плотность снижена, например, до 1.09, тогда электролит замерзнет уже при -7 градусах по Цельсию. Однако, если зимой обнаружено, что плотность понизилась, вместо того, чтобы сразу ее поднимать, нужно сначала хорошо зарядить АКБ от зарядного устройства.
На деле, зимой часто во время коротких поездок аккумулятор не успевает зарядиться, плохо накапливает заряд и т.д. В результате снижается заряд АКБ, а также падает и плотность. При этом плотность путем доливки кислоты изменять самостоятельно не рекомендуется.
Допускается изменение разве что путем использования дистиллированной воды для коррекции уровня (норма 1.5 см над пластинами в АКБ легковых авто или 3 см. в грузовых авто). При этом если АКБ новая или полностью работоспособная, изменение плотности электролита при полном разряде и полном заряде должно быть на отметке 0.15-0.16 г/см3.
Совет
Еще важно учесть, что нельзя использовать разряженный аккумулятор при минусовой температуре, так как электролит замерзает и разрушаются свинцовые пластины. На практике, если аккумулятор разряжен на половину зимой и больше чем на четверть летом, АКБ нужно подзарядить.
Что касается плотности аккумулятора летом, обычно банки пересыхают и плотность повышается. С учетом того, высокая плотность плохо влияет на пластины, лучше держать показатель на 0.02 г/см3 ниже оптимального значения в регионах с жарким климатом.
На деле, летом вода из банок АКБ активно испаряется, так как наружная температура воздуха и нагрев под капотом (где зачастую и стоит батарея) также приводят к сильному повышению температуры аккумулятора. В результате аккумулятор «кипит».
В результате аккумулятор «кипит».
При этом понижение плотности не сказывается на качестве отдачи тока при нагреве АКБ. Например, даже при 1,22 г/см3 батарея будет хорошо крутить стартер. Получается, если на улице жарко, уровень электролита понижается и повышается плотность. В свою очередь, высокая плотность «убивает» батарею.
Чтобы этого не произошло, нужно проверять уровень электролита и доливать воду в аккумулятор, понижая плотность и поддерживая нужный уровень раствора в банках, чтобы предотвратить перезаряд и осыпание пластин.
При этом следует помнить, что постоянные доливки воды в аккумулятор приводят к тому, что плотность падает.
При низкой плотности дальше пользоваться батареей нельзя, так как требуется повысить плотность электролита в аккумуляторе.
Как проверить плотность в аккумуляторе
Разобравшись с тем, на что влияет плотность в АКБ и какой она должна быть, перейдем к тому, как проверяется плотность в аккумуляторе. Такую проверку нужно выполнять каждые 20-25 тыс. км. пробега, а также перед наступлением лета и зимы.
Такую проверку нужно выполнять каждые 20-25 тыс. км. пробега, а также перед наступлением лета и зимы.
Для замера нужен прибор, который называется ареометр (денсиметр). Фактически, это стеклянная трубка с ареометром внутри. На одном конце есть наконечник из резины, а на другом груша.
Для проверки следует поочередно выкручивать крышки банок обслуживаемого аккумулятора, затем погрузить резиновый наконечник в раствор, грушей втянуть электролит. Далее ареометр со шкалой покажет, какова плотность раствора. Чем меньше плотность, тем ниже заряд батареи.
Кстати, еще добавим, что необслуживаемые АКБ проверить данным способом не удается, так как нет прямого доступа к банкам. При этом на таких АКБ есть особый цветовой индикатор заряда (индикатор плотности) необслуживаемого аккумулятора.
Обратите внимание
Фактически, если индикатор зеленый, тогда это указывает, что АКБ заряжена на 65 или 100%. Если же плотность низкая и батарею нужно заряжать, тогда индикатор будет черным. Более того, если цвет, например, красный, тогда это указывает на выкипание воды и необходимость долива. Кстати, на самой АКБ должна быть наклейка, указывающая, о чем говорит цвет индикатора в том или ином случае.
Более того, если цвет, например, красный, тогда это указывает на выкипание воды и необходимость долива. Кстати, на самой АКБ должна быть наклейка, указывающая, о чем говорит цвет индикатора в том или ином случае.
Теперь вернемся к проверке. Проверка плотности электролита должна производиться на полностью заряженном аккумуляторе. При этом заряжать АКБ можно только тогда, когда уровень в банках в норме. Другими словами, порядок следующий:
- сначала корректируется уровень электролита, затем АКБ заряжается полностью;
- после окончания зарядки и отключения ЗУ также следует дать батарее «устояться» около 2-3 часов.
- после выполняется проверка плотности электролита в аккумуляторе.
Если долить воду или зарядить АКБ и сразу мерить плотность, данные будут не точными. Также важно измерять плотность при оптимальной температуре воздуха. Если имеют место отклонения, тогда нужно сверяться с приведенной выше таблицей и вносить поправки.
Когда делается забор электролита, ареометр должен быть в покое и плавать, при этом не касаться стенок. Замеры из каждой банки АКБ следует записать. Важно, чтобы плотность электролита была приблизительно одинаковой во всех банках.
Замеры из каждой банки АКБ следует записать. Важно, чтобы плотность электролита была приблизительно одинаковой во всех банках.
Если замечено, что плотность сильно понизилась в одной банке или нескольких, но не во всех, тогда это указывает на дефекты. Как правило, речь идет о коротком замыкании пластин аккумулятора. Если же плотность упала во всех банках, это указывает на то, что АКБ в глубоком разряде, пластины осыпались или старая батарея отработала свой ресурс.
Для точного определения причины нужно проверить напряжение аккумулятора мультиметром и с нагрузочной вилкой. В случае, когда плотность высокая, это также говорит о проблемах. Как правило, плотность повышается, когда электролит закипает.
Так или иначе, нужна корректировка с использованием корректирующего раствора или дистиллированной воды, после чего выполняется зарядка АКБ номинальным током (около 30 мин), а также затем батарея выдерживается нескольких часов в состоянии покоя. Это нужно, чтобы выровнять плотность в банках. Давайте рассмотрим, как повысить плотность электролита в аккумуляторе, более подробно.
Давайте рассмотрим, как повысить плотность электролита в аккумуляторе, более подробно.
Как поднять плотность аккумулятора
Прежде всего, важно знать, как правильно поднимать плотность в аккумуляторе. Прежде всего, при работе с электролитом нужно быть предельно осторожным, так как в составе раствора есть серная кислота.
Кислота может вызывать ожоги кожи, слизистых и дыхательных путей. Работать с электролитом нужно в хорошо проветриваемом помещении, надевать перчатки, маску и т.д. Еще нужно учитывать все нюансы и знать, как поднять плотность в аккумуляторе.
Важно
Обратите внимание, необходимость это делать возникает в том случае, когда уровень электролита в банках несколько раз корректировался водой или замеры плотности указывают, что плотность слишком низкая для зимы.
Также повышать плотность нужно после длительных перезарядок аккумулятора. Как правило, поднимать плотность нужно, если интервал заряда и разряда заметно сократился. Для понятия плотности АКБ можно использовать концентрированный электролит (корректирующий раствор электролита) или просто добавить кислоты.
Для понятия плотности АКБ можно использовать концентрированный электролит (корректирующий раствор электролита) или просто добавить кислоты.
В любом случае, нужно иметь ареометр, мерный стакан, емкость для разведения электролита, корректирующий раствор электролита или кислоту, дистиллированную воду.
- В общих чертах, из банки аккумулятора грушей откачивается немного электролита, затем в таком же количестве добавляется корректирующий электролит для поднятия плотности или дистиллированная вода для понижения;
- Затем АКБ на 30 минут ставится на зарядку от ЗУ, заряжать нужно номинальным током, чтобы жидкость смешалась;
- Далее батарея отключается от ЗУ, выдерживается пауза около 2-3 часов, чтобы за это время плотность во всех банках выровнялась, вышли пузырьки газов, снизалась температура;
- Теперь можно снова проверить плотность электролита, при необходимости, повторить процедуру, уменьшая или увеличивая количество;
- При замерах разница плотности во всех банках не должна быть больше 0,01 г/см3.
 Если такой плотности не удается добиться, тогда нужно снова делать так называемую выравнивающую зарядку, причем током, который в 2-3 раза меньше номинального тока заряда.
Если такой плотности не удается добиться, тогда нужно снова делать так называемую выравнивающую зарядку, причем током, который в 2-3 раза меньше номинального тока заряда.
Чтобы было удобнее, рекомендуется заранее изучить, какой объем в см3 в каждой банке конкретного АКБ. Сам электролит имеет состав в следующих пропорциях: 40% серной кислоты на 60% дистиллированной воды. Кстати, пропорции и плотность можно рассчитывать и по формуле, однако на практике проще воспользоваться таким методом:
- из банки откачивается жидкость и сливается в мерный стакан, что позволяет определить объем;
- затем сливается половина от полученного количества, а другая заполняется электролитом (стакан нужно покачать для перемешивания).
Если значения плотности все равно низкие, тогда можно долить еще ¼ электролита от выкачанного из банки объема. Такой долив можно производить неоднократно, уменьшая количество в два раза.
При этом, если плотность в аккумуляторе слишком низкая (ниже 1. 18), в этом случае недостаточно обычной доливки электролита. В подобной ситуации нужно добавлять кислоту (1.8 г/см3).
18), в этом случае недостаточно обычной доливки электролита. В подобной ситуации нужно добавлять кислоту (1.8 г/см3).
Сама процедура аналогична добавке электролита. Единственное, добавлять кислоту в раствор нужно шаг за шагом, так как можно сразу залить большое количество и превысить необходимые показатели. Обратите внимание, во время приготовления раствора в обязательном порядке нужно заливать кислоту в воду. Вливать воду в кислоту запрещается!
Советы и рекомендации
Как показывает практика, срок службы АКБ (средних по цене) составляет 3-4 года, дорогие аналоги могут прослужить на 1-2 года больше. При этом такие показатели возможны только в том случае, если соблюдаются правила эксплуатации и обслуживания, а также оборудование исправно.
Прежде всего, важно не допускать перезаряда аккумулятора или, наоборот, глубокого разряда батареи. Как правило, сильно посадить аккумулятор может сам владелец.
Также к разряду приводят неисправности электрооборудования или ошибки при подключении. Так или иначе, потребители «тянут» заряд даже тогда, когда машина не используется, АКБ садится.
Так или иначе, потребители «тянут» заряд даже тогда, когда машина не используется, АКБ садится.
Что касается перезаряда, это может происходить в результате поломок реле-регулятора и т.д.
В любом случае, если аккумулятор необслуживаемый и/или старый (отработал больше 3-х или 4-х лет), тогда пытаться восстановить его работоспособность путем замены электролита не стоит. Зачастую, в этом случае в банках уже осыпались пластины (частично или полностью). Результат- батарея не будет работать нормально даже со свежим электролитом.
Зачастую, если электролит в аккумуляторе стал коричневым или бурым, в морозы такая батарея если и будет работать, то плохо.
Если же электролит почернел, это указывает на то, что произошло осыпание пластин и частицы попали в раствор. На деле, площадь поверхности пластин стала меньше.
Получается, даже после обслуживания и зарядки получить необходимые характеристики АКБ не представляется возможным. В таком случае батарею лучше сразу поменять.
Что в итоге
Как видно, плотность электролита, уровень и его состояние в аккумуляторе является важнейшими показателями. По этой причине даже не нормально работающих батареях нужно следить за уровнем электролита в банках АКБ, а также проверять и корректировать плотность при отклонении от нормы, с учетом климатических условий в регионе и т.д.
Напоследок отметим, что только правильное обслуживание, зарядка и соблюдение правил эксплуатации позволяет максимально повысить эффективность работы и увеличить срок службы аккумулятора автомобиля.
Источник: http://KrutiMotor.ru/kak-proverit-plotnost-akkumulyatora-i-povysit-ili-ponizit-plotnost-akb/
Обзор удельного веса электролита аккумулятора
Обзор удельного веса электролита аккумулятора
Применение и технология аккумуляторов
Удельный вес электролита аккумулятора Обзор
Одним из основных параметров работы аккумулятора является удельный вес электролита. Удельный вес – это отношение веса раствора к весу равного объема воды при определенной температуре. Удельный вес используется в качестве индикатора состояния заряда элемента или батареи. Однако измерения удельного веса не могут определить емкость батареи. Во время разрядки удельный вес уменьшается линейно по мере разрядки в ампер-часах, как показано на рисунке ниже.
Удельный вес – это отношение веса раствора к весу равного объема воды при определенной температуре. Удельный вес используется в качестве индикатора состояния заряда элемента или батареи. Однако измерения удельного веса не могут определить емкость батареи. Во время разрядки удельный вес уменьшается линейно по мере разрядки в ампер-часах, как показано на рисунке ниже.
Изменения напряжения и удельного веса во время заряда и разряда
Таким образом, при полной зарядке в установившемся режиме эксплуатации и на выгрузке, измерение удельного плотность электролита обеспечивает приблизительную индикация состояния заряда элемента. Нисходящий наклонная линия для удельного веса во время разряда аппроксимируется уравнением ниже:
Удельный вес = напряжение холостого хода элемента — 0,845
или
Напряжение разомкнутой цепи элемента = удельный вес
+ 0,845.
Приведенные выше уравнения допускают электрические периодический контроль приблизительного удельного веса основа. Как упоминалось ранее, измерения удельного веса нельзя брать на герметичные свинцово-кислотные аккумуляторы. Измерение напряжение холостого хода ячейки использовалось в качестве индикатор состояния заряда герметичной батареи. Более надежные методы определения состояния заряда герметичные батареи находятся в стадии разработки.
Удельный вес уменьшается во время разряд батареи до значения, близкого к чистой воде и увеличивается во время перезарядки. Батарея считается полностью заряженным, когда удельный вес достигает своего максимально возможное значение.
Удельный вес, конечно, зависит от
температура и количество электролита в ячейке. Когда
электролит близок к отметке низкого уровня, удельная
плотность выше номинальной и падает по мере добавления воды
в ячейку, чтобы довести электролит до полного уровня.
объем электролита увеличивается при повышении температуры и
сужается при понижении температуры, что влияет на
плотность или удельный вес. Так как объем
электролит расширяется, показания снижаются и,
наоборот, удельный вес увеличивается с понижением температуры.
температуры.
Когда
электролит близок к отметке низкого уровня, удельная
плотность выше номинальной и падает по мере добавления воды
в ячейку, чтобы довести электролит до полного уровня.
объем электролита увеличивается при повышении температуры и
сужается при понижении температуры, что влияет на
плотность или удельный вес. Так как объем
электролит расширяется, показания снижаются и,
наоборот, удельный вес увеличивается с понижением температуры.
температуры.
Удельный вес данной батареи составляет определяется приложением, в котором он будет использоваться, принимая с учетом рабочей температуры и времени автономной работы. Типичный удельный вес для определенных применений показан в Таблица 1.
Таблица 1
При подборе аккумулятора по заданному применение, некоторые эффекты высокой или низкой удельной силы тяжести, которые следует учитывать:
Высшая гравитация | Нижняя гравитация |
| Больше емкости | Меньше емкости |
| Меньший срок службы | Увеличенный срок службы |
| Требуется меньше места | Требуется больше места |
| Более высокая скорость мгновенного разряда | Более низкая скорость мгновенного разряда |
| Менее адаптируется к «плавающим»: операция | Более приспособлен к «плавающему» режиму |
| Больше постоянных убытков | За вычетом постоянных потерь |
Раствор с большей плотностью
тяжелее на единицу объема, чем вещество с меньшим удельным весом. Поэтому более концентрированный электролит, созданный во время
зарядка опускается на дно батарейного отсека, создавая
градиент удельного веса. Газообразование, происходящее на
перезарядка служит «смесителем» и заставляет
удельный вес однороден по всей клетке. Избегать
ошибочные показания, измерения удельного веса должны
приниматься только после уравнительного заряда и последующего
подзарядка не менее 72 часов.
Поэтому более концентрированный электролит, созданный во время
зарядка опускается на дно батарейного отсека, создавая
градиент удельного веса. Газообразование, происходящее на
перезарядка служит «смесителем» и заставляет
удельный вес однороден по всей клетке. Избегать
ошибочные показания, измерения удельного веса должны
приниматься только после уравнительного заряда и последующего
подзарядка не менее 72 часов.
Аккумуляторы из Na-металла с высокой плотностью энергии, работающие на специально разработанном электролите на основе карбоната
Цзявэй Чен, и Ю Пэн, и Юэ Инь, и Минчжу Лю, б Чжун Фанг, и Ихуа Се, и Боуэн Чен, с Юнцзе Цао, и Лидан Син, б Цзяньхан Хуанг, а Юнган Ван, и Сяоли Донг * и а также Юнъяо Ся * и
Принадлежности автора
* Соответствующие авторы
и Кафедра химии и Шанхайская ключевая лаборатория молекулярного катализа и инновационных материалов, Институт новой энергии, iChEM (Совместный инновационный центр химии энергетических материалов), Фуданьский университет, Шанхай, 200433, Китай
Электронная почта: xldong@fudan. edu.cn, [email protected]
edu.cn, [email protected]
б Национальный и местный объединенный инженерно-исследовательский центр MPTES в области высоких энергий и безопасности LIB, Инженерно-исследовательский центр MTEES (Министерство образования), Исследовательский центр BMET (провинция Гуандун), Key Lab. of ETESPG (GHEI), Инновационная платформа для ITBMD (муниципалитет Гуанчжоу), Школа химии, Южно-китайский педагогический университет, Гуанчжоу 510006, Китай
с i-Lab, Центр передового опыта CAS в области нанонауки, Сучжоуский институт нанотехнологий и нанобионики (SINANO), Китайская академия наук (CAS), Сучжоу 215123, Китай
Аннотация
rsc.org/schema/rscart38″> Высоковольтные натриево-металлические батареи (SMB) предлагают эффективный способ достижения высокой плотности энергии. Однако они одновременно предъявляют высокие требования к электролиту из-за пресловутой реакционной способности металла Na и каталитического характера агрессивных высоковольтных химий. Здесь мы изготавливаем специальный электролит на карбонатной основе с использованием дифторбис(оксалато)фосфата лития (LiDFBOP) в качестве многофункциональной добавки, где DFBOP − анионы могут образовывать стабильные и прочные межфазные границы как на аноде, так и на катоде. Между тем, Li + -ионы могут принимать участие в структуре сольватации, чтобы регулировать стабильность электролита, а также противостоять дендритному отложению посредством электростатического экранирования. Такая оптимизация эффективно реализует высокую кулоновскую эффективность (98,6%) и длительный срок службы (2600 ч) покрытия/зачистки Na вместе с улучшенной обратимостью Na 9. 0184 3 V 2 (PO 4 ) 2 F 3 Кат. Кроме того, собрано 4,5 В. после 220 циклов и высокой плотности энергии 295 Вт ч кг -1 с ограниченным содержанием Na. Предлагаемая стратегия электролитов может пролить свет на дальнейшую оптимизацию высокоэнергетических химических реакций с металлическим натрием.
0184 3 V 2 (PO 4 ) 2 F 3 Кат. Кроме того, собрано 4,5 В. после 220 циклов и высокой плотности энергии 295 Вт ч кг -1 с ограниченным содержанием Na. Предлагаемая стратегия электролитов может пролить свет на дальнейшую оптимизацию высокоэнергетических химических реакций с металлическим натрием.Разработка анодов натриевых аккумуляторов с высокой плотностью энергии для улучшения циклирования с использованием сверхконцентрированных ионно-жидких электролитов
- Артикул
- Опубликовано:
- Дмитрий А.
 Раков 1,2 ,
Раков 1,2 , - Фанфан Чен ORCID: orcid.org/0000-0002-8004-1720 1,2 ,
- Шамми А. Фердоуси 1 ,
- Хуа Ли 3,4 ,
- Тушан Патирана 1 ,
- 2 Александр Н. Симон
- 2 ORCID: orcid.org/0000-0003-3063-6539 5 ,
- Патрик С. Хоулетт ORCID: orcid.org/0000-0002-2151-2932 1,2 ,
- Роб Аткин 3 и
- …
- Мария Форсайт ORCID: orcid.org/0000-0002-4273-8105 1,2
Природные материалы том 19 , страницы 1096–1101 (2020)Процитировать эту статью
10 тыс.
 обращений
обращений87 цитирований
19 Альтметрический
Детали показателей
Предметы
- Батарейки
- Молекулярная динамика
- Физическая химия
Abstract
Неравномерное осаждение металла и образование дендритов в накопителях энергии высокой плотности снижает эффективность, безопасность и срок службы аккумуляторов с металлическими анодами. Сверхконцентрированные электролиты с ионной жидкостью (например, 1:1 ионная жидкость:щелочной ион) в сочетании с предварительным кондиционированием анода при более отрицательных потенциалах могут полностью смягчить эти проблемы и, следовательно, произвести революцию в устройствах хранения энергии с высокой плотностью. Однако механизмы, с помощью которых очень высокая концентрация соли и потенциал предварительного кондиционирования обеспечивают равномерное осаждение металла и предотвращают образование дендритов на металлическом аноде во время циклирования, плохо изучены и, следовательно, не оптимизированы. Здесь мы используем атомно-силовую микроскопию и моделирование молекулярной динамики, чтобы выяснить влияние этих факторов на химию интерфейса в натриевом электролите, демонстрируя, как расплавленная солевая структура на поверхности электрода приводит к бездендритоподобному циклированию металла с более высокой скоростью. . Такая структура будет способствовать формированию более благоприятной межфазной фазы твердого электролита, что считается критическим фактором стабильной цикличности батареи. Это новое понимание позволит разработать эффективные анодные электроды путем настройки межфазной наноструктуры с помощью концентрации соли и предварительного кондиционирования высокого напряжения.
Однако механизмы, с помощью которых очень высокая концентрация соли и потенциал предварительного кондиционирования обеспечивают равномерное осаждение металла и предотвращают образование дендритов на металлическом аноде во время циклирования, плохо изучены и, следовательно, не оптимизированы. Здесь мы используем атомно-силовую микроскопию и моделирование молекулярной динамики, чтобы выяснить влияние этих факторов на химию интерфейса в натриевом электролите, демонстрируя, как расплавленная солевая структура на поверхности электрода приводит к бездендритоподобному циклированию металла с более высокой скоростью. . Такая структура будет способствовать формированию более благоприятной межфазной фазы твердого электролита, что считается критическим фактором стабильной цикличности батареи. Это новое понимание позволит разработать эффективные анодные электроды путем настройки межфазной наноструктуры с помощью концентрации соли и предварительного кондиционирования высокого напряжения.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Соответствующие статьи
Статьи открытого доступа со ссылками на эту статью.
Ионные жидкости на незаряженных и заряженных поверхностях: микроструктуры in situ и нанотрение
- Ронг Ан
- , Юди Вэй
- … Вэньлин Чжан
Трение Открытый доступ 12 апреля 2022 г.
Варианты доступа
Подписаться на журнал
Получить полный доступ к журналу на 1 год
118,99 €
всего 9,92 € за выпуск
Подписаться
Расчет налогов будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
32,00 $
Купить
Все цены указаны НЕТТО.
Рис. 1: Межфазная многослойная структура IL с помощью измерения силы с помощью АСМ и моделирования методом МД. Рис. 2: Анализ количества различных ионов в самом внутреннем межфазном слое. Рис. 3: Координация Na–FSI в самом внутреннем слое электролита. Рис. 4: Электрохимические эксперименты при 50 °C на Na|50 мол.% NaFSI в симметричной ячейке C3mpyrFSI|Na с различными предварительными условиями.Доступность данных
Данные, представленные на рис. 1–4 приводятся в статье в качестве исходных данных. Все остальные данные, подтверждающие результаты этого исследования, можно получить у соответствующих авторов по обоснованному запросу.
Каталожные номера
- «>
Сюй, К. Электролиты и промежуточные фазы в литий-ионных батареях и не только. Хим. Ред. 114 , 11503–11618 (2014 г.).
КАС Google ученый
Cheng, X.B. et al. Обзор межфазных переходов твердого электролита на металлическом литиевом аноде. Доп. науч. 3 , 1–20 (2015).
Google ученый
Лин Д., Лю Ю. и Цуй Ю. Восстановление металлического литиевого анода для высокоэнергетических батарей. Нац. нанотехнологии. 12 , 194–206 (2017).
КАС Google ученый
Cheng, X.
 B., Zhang, R., Zhao, C.Z. & Zhang, Q. Безопасный литий-металлический анод в перезаряжаемых батареях: обзор. Хим. Ред. 117 , 10403–10473 (2017 г.).
B., Zhang, R., Zhao, C.Z. & Zhang, Q. Безопасный литий-металлический анод в перезаряжаемых батареях: обзор. Хим. Ред. 117 , 10403–10473 (2017 г.).КАС Google ученый
Lee, B., Paek, E., Mitlin, D. & Lee, S.W. Металлические натриевые аноды: новые решения для роста дендритов. Хим. Ред. 119 , 5416–5460 (2019).
КАС Google ученый
Ватанабэ, М. и др. Применение ионных жидкостей в материалах и устройствах для хранения и преобразования энергии. Хим. Ред. 117 , 7190–7239 (2017 г.).
КАС Google ученый
Мезгер, М. и др. Молекулярное расслоение фторированных ионных жидкостей на заряженной поверхности сапфира (0001). Прибой. науч. 322 , 424–428 (2008).
КАС Google ученый
«>Блэк, Дж. М. и др. Фундаментальные аспекты измерения силы-расстояния в двойном электрическом слое на границах раздела жидкость-твердое тело с использованием атомно-силовой микроскопии. наук. 6 , 1–12 (2016).
Google ученый
Блэк, Дж. М. и др. Смещенная структура молекулярного уровня двойного электрического слоя в ионной жидкости на графите. Нано Летт. 13 , 5954–5960 (2013).
КАС Google ученый
Смит, А. М., Ли, А. А. и Перкин, С. Длина электростатического экранирования в концентрированных электролитах увеличивается с концентрацией.
 J. Phys. хим. лат. 7 , 2157–2163 (2016).
J. Phys. хим. лат. 7 , 2157–2163 (2016).КАС Google ученый
Су, Ю.-З., Фу, Ю.-К., Ян, Ж.-В., Чен, З.-Б. и Мао, Б.-В. Двойной слой интерфейса Au(100)/ионная жидкость и его стабильность в ионных жидкостях на основе имидазолия. Анжю. хим. Междунар. Эд. 48 , 5148–5151 (2009).
КАС Google ученый
Эльбурн, А. и др. Наноструктура слоя Штерна ионная жидкость-графит. ACS Nano 9 , 7608–7620 (2015).
КАС Google ученый
Мотобаяши К., Минами К., Ниши Н., Сакка Т. и Осава М. Гистерезис потенциалзависимых изменений плотности ионов и структуры ионной жидкости на золотом электроде: in situ наблюдение с помощью инфракрасной абсорбционной спектроскопии с усилением поверхности. J. Phys. хим.
 лат. 4 , 3110–3114 (2013).
лат. 4 , 3110–3114 (2013).КАС Google ученый
Нанбу, Н., Сасаки, Ю. и Китамура, Ф. In situ ИК-Фурье спектроскопическое наблюдение межфазной фазы расплавленной соли и золотого электрода при комнатной температуре. Электрохим. коммун. 5 , 383–387 (2003).
КАС Google ученый
Рубим, Дж. К., Триндаде, Ф. А., Гелески, М. А., Арока, Р. Ф. и Дюпон, Дж. Колебательная спектроскопия с усилением поверхности ионной жидкости тетрафторбората 1-н-бутил-3-метилимидазолия (BMIBF4) на серебряных поверхностях. J. Phys. хим. C. 112 , 19670–19675 (2008 г.).
КАС Google ученый
Юань, Ю.-С., Ню, Т.-С., Сюй, М.-М., Яо, Ж.-Л. & Гу, Р.-А. Исследование адсорбции метилимидазола на границе раздела ионные жидкости/медный электрод с помощью спектроскопии комбинационного рассеяния с усилением поверхности.
 J. Raman Spectrosc. 41 , 516–523 (2010).
J. Raman Spectrosc. 41 , 516–523 (2010).КАС Google ученый
Baldelli, S. Структура поверхности на границе ионная жидкость-наэлектризованный металл. Согл. хим. Рез. 41 , 421–431 (2008).
КАС Google ученый
Ху З., Ватаману Дж., Бородин О. и Бедров Д. Исследование методом молекулярной динамики двойного электрического слоя и емкости [BMIM][PF 6 ] и [BMIM][ BF 4 ] ионные жидкости при комнатной температуре вблизи заряженных поверхностей. Физ. хим. хим. физ. 15 , 14234–14247 (2013).
КАС Google ученый
Бегич, С., Ли, Х., Аткин, Р., Холленкамп, А. Ф. и Хоулетт, П. К. Сравнительное АСМ-исследование межфазной наноструктуры в имидазолиевых или пирролидиниевых ионных жидких электролитах для цинковых электрохимических систем.
 Физ. хим. хим. физ. 18 , 29337–29347 (2016).
Физ. хим. хим. физ. 18 , 29337–29347 (2016).Google ученый
Forsyth, M. et al. Настройка межфазной химии натрия с помощью смешанных анионных ионных жидких электролитов. Приложение ACS Матер. Интерфейсы 11 , 43093–43106 (2019 г.).
КАС Google ученый
Лю, З. и др. Электроосаждение нанокристаллического цинка без дендритов из ионной жидкости, содержащей трифлат никеля, для аккумуляторных батарей на основе цинка. Анжю. хим. Междунар. Эд. 55 , 2889–2893 (2016).
КАС Google ученый
Ли, Х., Эндрес, Ф. и Аткин, Р. Влияние длины алкильной цепи и анионов на межфазную наноструктуру ионных жидкостей на границе раздела Au(111)-ионная жидкость в зависимости от потенциала. Физ. хим. хим. физ.
 15 , 14624–14633 (2013).
15 , 14624–14633 (2013).КАС Google ученый
Аткин Р. и соавт. Исследования АСМ и СТМ поверхностного взаимодействия ионных жидкостей [BMP]TFSA и [EMIm]TFSA с Au(111). J. Phys. хим. C 113 , 13266–13272 (2009).
КАС Google ученый
Карстенс, Т., Лахири, А., Борисенко, Н. и Эндрес, Ф. Ионный жидкий электролит на основе [Py1,4]-FSI-NaFSI для натриевых батарей: сольватация Na + и межфазная наноструктура на Золото (111). J. Phys. хим. C 120 , 14736–14741 (2016).
КАС Google ученый
Hoffmann, V. et al. Влияние соли серебра на наноструктуру границы раздела Au(111)/ионная жидкость: исследование атомно-силовой микроскопии и теоретические концепции. Физ. хим. хим. физ. 20 , 4760–4771 (2018).

КАС Google ученый
Лахири А., Карстенс Т., Аткин Р., Борисенко Н. и Эндрес Ф. Исследования атомно-силовой микроскопии in situ межфазной многослойной наноструктуры LiTFSI-[Py 1, 4 ]TFSI на Au (111): влияние концентрации ионов Li + на границу раздела Au(111)/ИЖ. J. Phys. хим. C 119 , 16734–16742 (2015).
КАС Google ученый
Girard, G. M. A. et al. Спектроскопическая характеристика слоя SEI, сформированного на электродах из металлического лития в фосфониевых бис(фторсульфонил)имидных ионных жидких электролитах. Приложение ACS Матер. Интерфейсы 10 , 6719–6729 (2018 г.).
КАС Google ученый
Yoon, H., Howlett, P.C., Best, A.S., Forsyth, M. & MacFarlane, D.R. Быстрая зарядка/разрядка литий-металлических аккумуляторов с использованием ионно-жидкого электролита.
 Дж. Электрохим. соц. 160 , 1629–1637 (2013).
Дж. Электрохим. соц. 160 , 1629–1637 (2013).Google ученый
Forsyth, M. et al. Роман На 9Механизм диффузии ионов 0098 + в смешанном органо-неорганическом ионном жидком электролите, приводящий к высокому числу переноса Na + и стабильному высокоскоростному электрохимическому циклированию натриевых элементов. J. Phys. хим. C 120 , 4276–4286 (2016).
КАС Google ученый
Zhang, H. et al. Ионный жидкий электролит с высокой концентрацией LiTFSI для литий-металлических аккумуляторов. Электрохимика Acta 285 , 78–85 (2018).
КАС Google ученый
Чоудхури, С. и др. Проектирование межфазных поверхностей твердое тело-жидкость для натриевых аккумуляторов. Нац. коммун. 8 , 1–10 (2017).

Google ученый
Перияпперума, К. и др. К высокоскоростным литий-металлическим анодам: повышенная производительность при высокой плотности тока в сверхконцентрированной ионной жидкости. Дж. Матер. хим. А 8 , 3574–3579 (2020).
Уэйкхэм, Д., Нельсон, А., Уорр, Г. Г. и Аткин, Р. Исследование поверхности протонной ионной жидкости с использованием отражательной способности рентгеновских лучей. Физ. хим. хим. физ. 13 , 20828–20835 (2011).
КАС Google ученый
Chen, F., Howlett, P. & Forsyth, M. Сольватация ионов Na и высокое число переноса в сверхконцентрированных ионных жидких электролитах: теоретический подход. J. Phys. хим. C 122 , 105–114 (2018).
КАС Google ученый
«>Мацумото К., Окамото Ю., Нохира Т. и Хагивара Р. Термические и транспортные свойства Na[N(SO2F)2]-[N-метил-N-пропилпирролидиний][N(SO2F) )2] ионные жидкости для Na-аккумуляторов. J. Phys. Химия . C 119 , 7648–7655 (2015).
Vicent-Luna, J.M. et al. Квантовая и классическая молекулярная динамика ионных жидких электролитов для аккумуляторов на основе Na/Li: молекулярные причины поведения проводимости. ХимФизХим 17 , 2473–2481 (2016).
КАС Google ученый
Giffin, G. A., Moretti, A.
 , Jeong, S. & Passerini, S. Отделение эффективной ионной проводимости Li + от вязкости электролита для улучшения характеристик элемента при комнатной температуре. J. Power Sources 342 , 335–341 (2017).
, Jeong, S. & Passerini, S. Отделение эффективной ионной проводимости Li + от вязкости электролита для улучшения характеристик элемента при комнатной температуре. J. Power Sources 342 , 335–341 (2017).КАС Google ученый
Гао, X., Ву, Ф., Мариани, А. и Пассерини, С. Концентрированные электролиты на основе ионной жидкости для высоковольтных литиевых батарей с улучшенными характеристиками при комнатной температуре. ChemSusChem 12 , 4185–4193 (2019).
КАС Google ученый
Wróbel, P., Kubisiak, P. & Eilmes, A. Взаимодействия в электролитах бис(фторсульфонил)имида натрия/1-этил-3-метилимидазолия бис(фторсульфонил)имида для Na-ионных аккумуляторов: выводы из молекулярной динамики симуляции. J. Phys. хим. C 123 , 14885–14894 (2019).
Google ученый
«>Такенака, Н. и др. Микроскопический механизм формирования межфазной пленки твердого электролита в литий-ионных аккумуляторах с высококонцентрированным электролитом. J. Phys. хим. C 122 , 2564–2571 (2018).
КАС Google ученый
Махлугиазад, Ф. и др. Кристаллическая соль фосфониевого пластика, легированная солью натрия, в качестве твердотельного электролита для натриевых устройств: фазовое поведение и электрохимические характеристики. Дж. Матер.
 хим. А 5 , 5770–5780 (2017).
хим. А 5 , 5770–5780 (2017).КАС Google ученый
Ян Х. и др. N- этил -N- пропилпирролидиний бис(фторсульфонил)амид ионные жидкие электролиты для натриевых вторичных батарей: влияние концентрации ионов Na. J. Phys. хим. C 123 , 22018–22026 (2019).
КАС Google ученый
Перияпперума, К. и др. Ионные жидкие электролиты на основе пирролидиния-дицианамида с высокой концентрацией Zn для Zn 2+ /Zn 0 Электрохимия в проточной среде. Приложение ACS Энергия Матер. 1 , 4580–4590 (2018).
КАС Google ученый
Линдал, Э., Хесс, Б. и ван дер Споэль, Д. GROMACS 3.0: пакет для молекулярного моделирования и анализа траекторий. Мол. Модель. Анну. 7 , 306–317 (2001).

КАС Google ученый
Ван Р., Би С., Прессер В. и Фэн Г. Систематическое сравнение силовых полей для молекулярно-динамического моделирования границ раздела Au(111)/ионная жидкость. Равновесие жидкой фазы. 463 , 106–113 (2018).
КАС Google ученый
Ватаману Дж., Син Л., Ли В. и Бедров Д. Влияние температуры на емкость ионных жидких электролитов на заряженных поверхностях. Физ. хим. хим. физ. 16 , 5174–5182 (2014).
КАС Google ученый
Федоров М.В., Корнышев А.А. Ионные жидкости на электрифицированных границах раздела. Хим. Ред. 114 , 2978–3036 (2014).
КАС Google ученый
Мао, X. и др. Самособирающиеся наноструктуры в ионных жидкостях облегчают накопление заряда на электрифицированных границах раздела. Нац. Матер. 18 , 1350–1357 (2019).
КАС Google ученый
Хаскинс, Дж. Б., Баушлихер, К. В. и Лоусон, Дж. В. Моделирование Ab Initio и электронная структура ионных жидкостей, легированных литием: структура, перенос и электрохимическая стабильность. J. Phys. хим. B 119 , 14705–14719 (2015).
КАС Google ученый
Tsuzuki, S., Hayamizu, K. & Seki, S. Происхождение низковязкой ионной жидкости [emim][(FSO 2 ) 2 N] и ее смеси солей лития: экспериментальные и теоретическое исследование коэффициентов самодиффузии, проводимостей и межмолекулярных взаимодействий. J. Phys. хим. B 114 , 16329–16336 (2010).
КАС Google ученый
Скачать ссылки
Благодарности
D.A.R., F.C., M.F., P.C.H. и А.Н.С. выразить признательность Австралийскому исследовательскому совету (ARC) за финансирование через Австралийский центр электроматериаловедения, грант CE140100012. М.Ф. подтверждает предоставление ARC DP160101178. Работа по моделированию была проведена с помощью ресурсов, предоставленных системами NCI National Facility в Австралийском национальном университете в рамках Национальной схемы распределения заслуг в области вычислений, поддерживаемой правительством Австралии. Д.А.Р. благодарит С. Бегича и Э. Йонссона за обучение навыкам моделирования.
Работа по моделированию была проведена с помощью ресурсов, предоставленных системами NCI National Facility в Австралийском национальном университете в рамках Национальной схемы распределения заслуг в области вычислений, поддерживаемой правительством Австралии. Д.А.Р. благодарит С. Бегича и Э. Йонссона за обучение навыкам моделирования.
Информация об авторе
Авторы и организации
Институт пограничных материалов, Университет Дикина, Джилонг, Виктория, Австралия
Дмитрий А. Раков, Фангфанг Чен, Шамми А. Фердоуси, Мария Тушан Патирана, Хоулет Патрик Forsyth
ARC Центр передового опыта в области электроматериаловедения (ACES), Университет Дикина, Бервуд, Виктория, Австралия
Дмитрий А. Раков, Фанфан Чен, Патрик С. Хоулетт и Мария Форсайт
Школа молекулярных наук, Университет Западной Австралии, Кроули, Западная Австралия, Австралия
Хуа Ли и Роб Аткин
Центр микроскопии, характеризации и анализа, Университет Западной Австралии, Кроули, Западная Австралия, Австралия
Хуа Ли
Школа химии и Центр передового опыта в области электроматериаловедения Университета Монаш, Клейтон, Виктория, Австралия
Александр Н.
 Симонов
Симонов
Авторы
- Дмитрий А. Раков
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Fangfang Chen
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Shammi A. Ferdousi
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Хуа Ли
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Тушан Патирана
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Александр Н. Симонов
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Patrick C.
 Howlett
HowlettПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Rob Atkin
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Maria Forsyth
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Вклады
М.Ф. задумал идею. М.Ф. и ФК руководил проектом. Д.А.Р. провел моделирование МД под руководством Ф.К. и М.Ф. и провел эксперимент АСМ под руководством Р.А. и H.L. Электрохимический эксперимент был проведен S.A.F. при участии Т.П. под наблюдением и переводом P.C.H. Интерпретацию результатов и подготовку рукописи осуществляли D.A.R., F.C. и М.Ф. с обсуждением, комментариями и редактированием от R.A., P.C.H. и А.Н.С.
Авторы переписки
Переписка с Фанфан Чен или Мария Форсайт.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Дополнительный текст, Таблицы 1 и 2, Рис. 1–7 и исх. 1–11.
Исходные данные
Исходные данные Рис. 1
Картинки на Рис. 1 сохранены на слайде.
Исходные данные Рис. 2
Картинки на Рис. 2 сохранены на слайде.
Исходные данные Рис. 3
Картинки на Рис. 3 сохранены на слайде.
Исходные данные Рис. 4
Картинки на рис. 4 сохранены на слайде.
Исходные данные Рис. 1
Исходные данные для создания Рис. 1.
Исходные данные Рис. 2
Исходные данные для генерации Рис. 2.
Исходные данные Рис. 3
Исходные данные для генерации Рис. 3.
Исходные данные Рис. 4
Исходные данные для генерации Рис. 4 .
4 .
Электролиты с низкой сольватацией для высоковольтных натрий-ионных аккумуляторов
- Ян Цзинь
- Фунг М.Л. Ле
- Цзи-Гуан Чжан
Энергия природы (2022)
Термодинамические, избыточные свойства и межмолекулярные взаимодействия ионной жидкости тиоцианата 1-этил-3-метилимидазолия и смесей пропиленкарбоната
- Гуси Ван
- Чжэн Син
- Цинго Чжан
Журнал химии растворов (2022)
Ионные жидкости на незаряженных и заряженных поверхностях: микроструктуры in situ и нанотрение
- Ронг Ан
- Юди Вэй
- Вэньлин Чжан
Трение (2022)
Основы, состояние и перспективы аккумуляторов на основе натрия
- Роберт Усискин
- Ясян Лу
- Иоахим Майер
Материалы Nature Reviews (2021)
Высоковольтный электролит для литий-ионных аккумуляторов
Guoyong Huang, Xi Dong, Jianwei Du, Xiaohua Sun, Botian Li, Haimu Ye. Высоковольтный электролит для литий-ионных аккумуляторов[J]. Прогресс в химии , 2021, 33(5): 855-867.
Высоковольтный электролит для литий-ионных аккумуляторов[J]. Прогресс в химии , 2021, 33(5): 855-867.
Литий-ионные аккумуляторы являются разновидностью экологически чистых перезаряжаемых аккумуляторов с высокой плотностью энергии и мощности и являются первым выбором портативных электронных устройств, которые постепенно применяются в области транспортных средств. Чтобы лучше соответствовать требованиям приложений, необходимо дополнительно улучшить плотность энергии современных литий-ионных аккумуляторов. В отличие от быстрого развития высоковольтных анодных материалов, традиционный электролит легко разлагается при высоком рабочем напряжении, что сильно препятствует коммерческому применению литий-ионных аккумуляторов с высокой плотностью энергии. Являясь важным компонентом литий-ионных аккумуляторов, электролит оказывает важное влияние на рабочие характеристики литий-ионных аккумуляторов во многих аспектах. Поэтому необходимо срочно улучшить рабочее напряжение электролита для решения проблемы низкой энергоемкости литий-ионных аккумуляторов. В этой статье ход исследований высоковольтного электролита в стране и за рубежом в последние годы обобщается с точки зрения двух аспектов нового органического растворителя и высоковольтной добавки, представлено влияние теоретических расчетов на конструкцию высоковольтного электролита, обобщены и спрогнозированы развитие и перспективы высоковольтного электролита.
В этой статье ход исследований высоковольтного электролита в стране и за рубежом в последние годы обобщается с точки зрения двух аспектов нового органического растворителя и высоковольтной добавки, представлено влияние теоретических расчетов на конструкцию высоковольтного электролита, обобщены и спрогнозированы развитие и перспективы высоковольтного электролита.
Содержание
1 ВВЕДЕНИЕ
2 Новые растворители с широким электрохимическим окном
2.1 Флуорированные растворители
2.2.
3.1 Фосфорные добавки
3.2 Борированные добавки
3.3 Бензол и гетероциклические добавки
3.4 Прочие
4 Влияние теоретического расчета на приготовление высоковольтного электролита
5 Заключение и прогноз
Ключевые слова: литий-ионные аккумуляторы, электролит, растворитель, добавка, теоретический расчет
Рис. 1 Молекулярная структура некоторых фторированных растворителей
Рис. 2 Молекулярная структура некоторых растворителей на основе нитрила
2 Молекулярная структура некоторых растворителей на основе нитрила
Рис. 3 Молекулярная структура некоторых растворителей на основе сульфонов
Рис. 4 Молекулярные структуры некоторых ионных жидкостей
Стол 1 Свойства различных высоковольтных растворителей
| Solvent | Components | Oxidation potential | Capacity retention rate/% | ref | |
|---|---|---|---|---|---|
| Fluorinated | FEC | LNMO/MCMB, 1 mol/L LiPF 6 -FEC/DMC /EMC/HFPM(2∶3∶1∶4, по объему) | 5,5 В | 82.0(0,5°С, 200 циклов) | 17 |
| ЭТФЭХ | LNMO/Li, 1 моль/л LiPF 6 — ЭТФ/ДЭК/ЭТФЭ(3∶1204 25 вес. ) 6,5 В ) 6,5 В | 90,5(0,2°С, 300 циклов) | 21 | ||
| ТТЭ | LNMO/Li,1 моль/л LiPF 6 -ФЭЦ/ДМК/2∶3ⶶ3∶ЭМС/ТТЭ | 5,5 В | 98,3(1 C, 200 циклов) | 24 | |
| На основе нитрила | ADN | MCMB/LiCoO 2 , 1 моль/л LiTFSI+0. 1 mol/L LiBOB-ADN/EC(1∶1, by volume) | 6.0 V | 90.0(C/12, 500 cycles) | 29 |
| GLN | MCMB/LiCoO 2 , 1 моль/л LiTFSI+0,1 моль/л LiBOB-GLN/EC(1∶1, по объему) | 6,0 В | 74,0(C/12, 100 циклов) | 30 | |
| LGLN , 1 моль/л LiTFSI-MGLN | 4,6 В | 98,0 (0,5 C, 200 циклов) | 31 | ||
| BN | NMC/графит, 1 моль/л LiPF 6 -BN/EC(9∶1, по объему) + 3% FEC | 4,9 В | 9,1205 Cs, 5,1220 циклов )32 | ||
| Sulfone-based | EMS | LNMO/Li, 1 mol/L LiPF 6 -EMS/DMC(1∶1, by weight) | 5. 9 V 9 V | 97.8(0.2 C , 100 циклов) | 36 |
| SL | LNMO/графит, 3,25 моль/л LiFSI-SL | 5,0 В | 70.0(0.5 C, 1000 cycles) | 41 | |
| MESL | NMC/Li, 1 mol/L LiTFSI-MESL | 4.9 V | 43 | ||
| Ionic liquids | N 1123 TFSI | LiMn 2 O 4 /Li, 0,25 моль/л LiTFSI-N 1123 TFSI/EC(8∶2, по объему) | 6,0 В 5 цикл | 51 | |
| PYR 13 TFSI | LNMO/LI, 3 моль/L LIPF 6 -EC/DEC+25% PYR 13 TFSI | 5,6 В | 97,0 (1 C, 300 циклов) | 52 | |
1220). 2O2) TFSI 2O2) TFSI | LiFePO 4 /Li, 1,0 моль/л LiTFSI-PYR 1(2O2) TFSI/DMC(8:2, по объему) | \ | 3,2020 цикл C )53 | ||
Рис. 5 Механизм формирования пленки различных добавок ячеек NMC532/AG, а также разная толщина и компоненты в соответствующем SEI на аноде[58]
Рис. 6 Молекулярная структура некоторых фосфорных добавок
Рис. 7 Молекулярные структуры некоторых борсодержащих добавок
Рис. 8 Молекулярная структура некоторых бензола и гетероциклических добавок
Рис. 9 Молекулярная структура некоторых добавок
Стол 2 Свойства различных высоковольтных добавок
| растворитель | Компоненты | Потенциал окисления | Удерживание пропускной способности/% | ref | |||||
|---|---|---|---|---|---|---|---|---|---|
| Фосфор | TMSP | ||||||||
| 5,0 В | 80,5(0,5 С, 300 циклов) | 61 | |||||||
| ТФП | NMC532/графит, 1 моль/л LiPF 3,7% EM 6 | ||||||||
| WT% TPP | 6,5 В | 58,3 (1 C, 400 циклов, 55 ℃) | 62 | ||||||
| TPPO | NMC811/GRAPHITE, 1 -MOL/L LIPF 6 -EMC811/GRAPHITE, 1 -MOL/L LIPF 6 -EMC811/GRAPHITE, 1 -MOL/L LIPF 6 -EMC811/GRAPTITE, 1 -MOL/L LIPF 6 -EMC811. | 5,4 В | 92,0(0,5 С, 100 циклов) | 63 | |||||
| ТПФПП | LLO/графит, 1 моль/л LiPF 6 -EC/EMC(3∶7, мас. %) + 0,5 мас.% TPFPP %) + 0,5 мас.% TPFPP | 5,4 В | 90,6(0,3°C, 200 циклов) | 50 | |||||
| Борированный | TIB | NMC622/Li, 1 моль/л LiPF 6 -EC/EMC/DEC(1∶1∶1, мас.%) + 1 мас.% TIB | >4,5 В 9046 8 1 C, 300 циклов) | 68 | |||||
| ТМБ | LiCoO 2 /Li, 1 моль/л LiPF 6 -EC/DMC(1∶1, об.% TPF) + 2 мас.0045 | 5,5 В | 81,0(0,1 C, 100 циклов) | 69 | |||||
| TPFPB | LNMO/Li, 1 моль/л LiPF 5 — 901EC WT% TPFPB | 5,6 V | 90,0 (0,5 C, 500 циклов) | 70 | |||||
| Libob | LNMO/LI, 1,3 моль 9184 6 -EC/EMC/EMC/SMC/SMC/SMC/SMC/SMC/SMC/D -EC/ECM. 3, об.%) + 1 мас.% LiBOB 3, об.%) + 1 мас.% LiBOB | >4,6 В | 78,7(0,5 C, 80 циклов, 60 ℃) | 73 | |||||
| LiDFOB | LiCoPO 4 /Li, 1 моль/л LiPF 6 -EC/PC/EMC(1∶1∶3, об.%) + 5 мас.% LiDFOB | 4,9 В | 69,4(0,1 C, 40 cycles) | 82 | |||||
| Benzene Heterocyclic | 4-ABA | Li 1.2 Ni 0.2 Mn 0.6 O 2 /Li, 1 mol/L LiPF 6 -EC/DEC (1∶1, об. %) + 0,25 % масс.0050 | |||||||
| BzTz | LiCoO 2 /графит, 1 моль/л LiPF 6 -ЭЦ/ДМК(3∶7, об. %) + 1 мас.% BzTz %) + 1 мас.% BzTz | 1,5 0,6 В | 7(0) 4,6045 Циклы) | 85 | |||||
| 3thp | LNMO/LI, 1 моль/L LIPF 6 -EC/DMC (1∶2, VOL%) + 0,25 WT% 3thP | 4,9 V. | 486 | ||||||
| Прочие | VC | NMC532/графит, 1 моль/л LiPF 6 -EC/DMC/PC(1∶3∶2 % об.) +1, мас. ВК | 4,7 В | 90,7(1 C, 120 циклов) | 90 | ||||
| PS | Li-rich-NMC/Li, 1 моль/л LiPF (1ⶶ-EC/EMC 9018 %) + 1 мас. % PS % PS | 4,6 В | 88,4(0,2 C, 240 циклов) | 89 | |||||
| SA | NMC811/Li, 1 моль/л Li14EM 6(06-18 Li14EM 6(06-18) 90 7, мас.%) + 3 мас.% SA | 5,6 В | 93,8(1 С, 400 циклов) | 91 | |||||
| БДТТ | NMC532/графит, 19 моль/л0184 6 -EC/EMC(3∶7, об.%) + 1 мас.% VC+2 мас.% BDTT | 86,0(0,5 C, 200 циклов) | 92 | ||||||
7
7 Стол 3 Значения ВЗМО и НСМО некоторых растворителей[21]
| Молекула | HOMO (EV) | HOMO (EV) |
|---|---|---|
| EC | -8,47 | -0,60 | -0,60 | -8,470041 | DEC | -8. 02 02 | -0.42 |
| FEC | -8.97 | -0.64 |
| ETFEC | -8.63 | -0.48 |
| DTFEC | -9.22 | -0.68 |
Рис. 10 (а) Расчетные значения ВЗМО растворителей и молекул добавок, а также органических молекул, сольватированных ионами Li; (б) Расчетные значения ВЗМО и НСМО различных комплексов с числом молекул растворителя, координирующих с БПКФП [9].6]
Рис. 11 Энергии реакции в фазе растворителя (ΔG в ккал·моль-1) ТМСБ и ТМСБ+ с молекулой LiF[97]
Рис. 12 Энергии реакции ТФФ с молекулой HF в фазе растворителя[62]
Стол 4 Преимущества и недостатки различных высоковольтных растворителей
| Категория | Advantage | Недостаток | |
|---|---|---|---|
| Флуорированные | Стабильность окисления, неплат. | Широкое электрохимическое окно (>8 В), низкое давление паров, высокая температура кипения, высокая температура вспышки | Высокая вязкость, плохая смачивающая способность с сепаратором и катодом |
| На основе сульфона | Высокий потенциал окисления (>5,4 В), высокая диэлектрическая проницаемость, высокая температура вспышки | Высокая вязкость, низкая ионная проводимость | |
| Ионная жидкость | Высокая химическая и термическая стабильность, широкое электрохимическое окно, негорючий | Высокая стоимость, высокая вязкость, плохая смачивающая способность с сепаратором и катодом |
| [1] | Nitta N, Wu F X, Lee J T, Yushin G. doi: 10.1016/j.mattod.2014.10.040 |
| [2] | Zeng X Q, Li M, Abd El-Hady D, Alshitari W, Al-Bogami A S, Lu J, Amine K. Adv. Энергетика, 2019, 9(27):1 1. дои: 10.1002/aenm.v9.27 |
| [3] | Pan H L, Han K S, Engelhard M H, Cao R G, Chen J Z, Zhang J G, Mueller K T, Shao Y Y, Liu J. Adv. Функц. мат., 2018, 28(38):1707234. дои: 10.1002/adfm.v28.38 |
| [4] | Girishkumar G, McCloskey B, Luntz A C, Swanson S, Wilcke W. J. Phys. хим. Письма., 2010, 1(14):2193. дои: 10.1021/jz1005384 |
| [5] | Tu S B, Chen X, Zhao X X, Cheng M R, Xiong P X, He Y W, Zhang Q, Xu Y H. Adv. мат., 2018, 30(45):1804581. дои: 10.1002/adma.v30.45 |
| [6] | Чжао З. doi: 10.1002/anie.201710156 |
| [7] | Li J C, Ma C, Chi MF, Liang C D, Dudney N J. Adv. Энергетические мат., 2015, 5(4):1401408. doi: 10.1002/aenm.201401408 |
| [8] | Сантанам Р., Рамбабу Б.Дж. Источники питания, 2010 г., 195(13):4313. doi: 10.1016/j.jpowsour.2010.01.016 |
| [9] | Чжун К., Бонакдарпур А., Чжан М., Гао Ю., Дан Дж. Р. ХимИнформ, 2010, 28(20):205. |
| [10] | Черкашинин Г., Шарат С.У., Ягерманн В. Adv. Энергетические мат., 2017, 7(13):1602321. doi: 10.1002/aenm.201602321 |
| [11] | Yim T, Woo S G, Lim S H, Cho W, Song J H, Han Y K, Kim Y J J Mater. дои: 10.1039/C4TA06531J |
| [12] | Song Y M, Han J G, Park S, Lee K T, Choi N S. J. Mater. хим. А, 2014, 2(25):9506. дои: 10.1039/C4TA01129E |
| [13] | Flamme B, Rodriguez Garcia G, Weil M, Haddad M, Phansavath P, Ratovelomanana-Vidal V, Chagnes A. Green Chem., 2017, 19(8): 1828. дои: 10.1039/C7GC00252A |
| [14] | Чой Н.С., Ю К.Х., Ли К.Ю., Сун М., Ким Х., Ким С.С.Дж. Power Sources, 2006, 161(2):1254. doi: 10.1016/j.jpowsour.2006.05.049 |
| [15] | Моги Р., Инаба М., Чон С.К., Ирияма Ю., Абэ Т., Огуми З. Дж. Электрохим. Soc., 2002, 149(12):A1578. дои: 10.1149/1.1516770 |
| [16] | Ху Л.Б., Чжан З. doi: 10.1016/j.elecom.2013.08.009 |
| [17] | Xia L, Xia Y G, Wang C S, Hu H S, Lee S, Yu Q, Chen HC, Liu Z P. ChemElectroChem, 2015, 2(11):1707. doi: 10.1002/celc.201500286 |
| [18] | Smart MC, Ratnakumar BV, Whitcanack LD, Chin KB, Surampudi S, Croft H, Tice D, Staniewicz R.J. Power Sources, 2003, 119/121:349. дои: 10.1016/S0378-7753(03)00154-X |
| [19] | Мацуда Ю., Накадзима Т., Одзава Ю., Ко М., Ямаути А., Кагава М., Аояма Х. Дж. Fluor. хим., 2011, 132(12):1174. doi: 10.1016/j.jfluchem.2011.07.019 |
| [20] | He M N, Hu L B, Xue Z, Su C C, Redfern P, Curtiss L A, Polzin B, von Cresce A, Xu K, Zhang Z C. J. Electrochem. соц., 2015, 162(9).):A1725. дои: 10.1149/2.0231509jes |
| [21] | Zheng X, Liao Y, Zhang ZR, Zhu JP, Ren FC, He HJ, Xiang Y X, Zheng Y Z, Yang Y. J. Energy Chem., 2020, 42:62. doi: 10.1016/j.jechem.2019.05.023 |
| [22] | Kim C K, Shin D S, Kim K E, Shin K, Woo J J, Kim S, Hong S Y, Choi N S. ChemElectroChem, 2016, 3(6):913. doi: 10.1002/celc.201600025 |
| [23] | Xia L, Yu LP, Hu D, Chen Z G. Acta Chim. Синица, 2017, 75(12):1183. дои: 10.6023/A17060284 |
| [24] | Xia L, Lee S, Jiang Y B, Li S Q, Liu Z P, Yu LP, Hu D, Wang S H, Liu Y T, Chen G Z. ChemElectroChem, 2019, 6(14):3747. дои: 10.1002/celc.v6.14 |
| [25] | Zhang L L, Ma Y L, Du C Y, Yin G P. |
(张玲玲, 马玉林, 杜春雨, 尹鸽平, 化学进展, 2014, 26:553.). дои: 10.7536/PC130816 | |
| [26] | Уэ М., Такеда М., Такехара М., Мори С.Дж. Электрохим. Соц., 1997, 144(8):2684. дои: 10.1149/1.1837882 |
| [27] | Duncan H, Salem N, Abu-Lebdeh Y. J. Electrochem. Soc., 2013, 160(6):A838. дои: 10.1149/2.088306jes |
| [28] | Rohan R, Kuo T C, Lin J H, Hsu Y C, Li C C, Lee J T. J. Phys. хим. С, 2016, 120(12):6450. doi: 10.1021/acs.jpcc.6b00980 |
| [29] | Абу-Лебде Ю., Дэвидсон И. Дж. Электрохим. Soc., 2009, 156(1):A60. дои: 10.1149/1.3023084 |
| [30] | Абу-Лебде Й. doi: 10.1016/j.jpowsour.2008.09.113 |
| [31] | Farhat D, Lemordant D, Jacquemin J, Ghamouss F. J. Electrochem. соц., 2019, 166(14):A3487. дои: 10.1149/2.1261914jes |
| [32] | Хилбиг П., Ибинг Л., Винтер М., Чекич-Ласкович И. Энергии, 2019, 12(15):2869. doi: 10.3390/en12152869 |
| [33] | Zhang W L, Lan X Y, Shi Z W, Li C L. Chem. Бюлл., 2017, 80:1021. |
(张文林, 兰晓艳, 史紫薇, 李春利, 化学通报, 2017, 80:1021.). | |
| [34] | Цао G Z. Sci. China Mater., 2018, 61(10):1360. doi: 10.1007/s40843-018-9296-y |
| [35] | Flamme B, Rodriguez Garcia G, Weil M, Haddad M, Phansavath P, Ratovelomanana-Vidal V, Chagnes A. дои: 10.1039/C7GC00252A |
| [36] | Сюэ Л. Г., Уэно К., Ли С. Ю., Энджелл К. А. Дж. Источники питания, 2014, 262:123. doi: 10.1016/j.jpowsour.2014.03.099 |
| [37] | Wu F, Zhou H, Bai Y, Wang H L, Wu C. Приложение ACS. Матер. Интерфейсы, 2015, 7(27):15098. дои: 10.1021/acsami.5b04477 |
| [38] | Hess S, Wohlfahrt-Mehrens M, Wachtler M. J. Electrochem. Соц., 2015, 162(2):A3084. дои: 10.1149/2.0121502jes |
| [39] | Sun X G, Angell C A. Electrochem. Комм., 2005, 7(3):261. doi: 10.1016/j.elecom.2005.01.010 |
| [40] | Левандовски А., Курц Б., Свидерска-Мочек А., Куса Н. Дж. Источники энергии, 2014, 266:132. doi: 10.1016/j.jpowsour.2014.04.083 |
| [41] | Альварадо Дж., Шредер М.А., Чжан М.Х., Бородин О., Гоброгге Э., Ольгин М., Дин М.С., Гобет М., Гринбаум С., Мэн Ю.С., Сюй К. Матер. Сегодня, 2018, 21(4):341. doi: 10.1016/j.mattod.2018.02.005 |
| [42] | Чжан Т., Порчер В., Пайярд Э. Дж. Источники питания, 2018 г., 395:212. doi: 10.1016/j.jpowsour.2018.05.077 |
| [43] | Flamme B, Haddad M, Phansavath P, Ratovelomanana-Vidal V, Chagnes A. ChemElectroChem, 2018, 5(16):2279. doi: 10.1002/celc.201701343 |
| [44] | Макфарлейн Д. Р., Тачикава Н., Форсайт М., Прингл Дж. М., Хоулетт П. К., Эллиотт Г. Д., Дэвис Дж. Х., Ватанабэ М., Саймон П., Энджелл К. А. Energy Environ. наук, 2014, 7(1):232. дои: 10.  1039/C3EE42099J 1039/C3EE42099J |
| [45] | Ватанабэ М., Томас М.Л., Чжан С.Г., Уэно К., Ясуда Т., Докко К. Chem. Rev., 2017, 117(10):7190. doi: 10.1021/acs.chemrev.6b00504 |
| [46] | Zhang S G, Zhang J H, Zhang Y, Deng Y Q. Chem. Rev., 2017, 117(10):6755. doi: 10.1021/acs.chemrev.6b00509 |
| [47] | Эфтехари А., Лю Ю., Чен П. Дж. Источники питания, 2016 г., 334:221. doi: 10.1016/j.jpowsour.2016.10.025 |
| [48] | Seki S, Kobayashi Y, Miyashiro H, Ohno Y, Mita Y, Terada N, Charest P, Guerfi A, Zaghib K. J. Phys. хим. С, 2008, 112(42):16708. дои: 10.1021/jp805403e |
| [49] | Юэ З., Дуня Х., Мэй Х.Ю., МакГарри К., Мандал Б.К. Ionics, 2019 г., 25(12):5979. doi: 10.1007/s11581-019-03133-y |
| [50] | Bordes E, Douce L, Quitevis E L, Pádua AAH, Costa Gomes M. J. Chem. физ., 2018, 148(19):193840. дои: 10.1063/1.5010604 |
| [51] | Le LTM, Vo T D, Ngo K H P, Okada S, Alloin F, Garg A, Le P M L. J. Mol. лик., 2018, 271:769. doi: 10.1016/j.molliq.2018.09.068 |
| [52] | Wu C J, Rath PC, Patra J, Bresser D, Passerini S, Umesh B, Dong Q F, Lee TC, Chang J K. ACS Appl. Матер. Интерфейсы, 2019, 11(45):42049. дои: 10.1021/acsami.9b12915 |
| [53] | Zhang S J, Li J H, Jiang N Y, Li X Q, Pasupath S, Fang Y X, Liu Q B, Dang D. Chem. Азиат Ж., 2019, 14(16):2810. |
| [54] | Лян Ф. Х., Ю Дж. Л., Ван Д. doi: 10.1016/j.electacta.2019.03.110 |
| [55] | Xu K, von Cresce AJ Mater. хим., 2011, 21(27):9849. дои: 10.1039/c0jm04309e |
| [56] | Кан Х. Хим. Rev., 2014, 114(23):11503. дои: 10.1021/cr500003w |
| [57] | Цурумаки А., Бранчи М., Ригано А., Пояна Р., Панеро С., Наварра М. А. Electrochimica Acta, 2019, 315:17. doi: 10.1016/j.electacta.2019.04.190 |
| [58] | Qian Y X, Hu S G, Zou X S, Deng Z H, Xu Y Q, Cao Z Z, Kang Y Y, Deng Y F, Shi Q, Xu K, Deng Y H. Материал накопления энергии, 2019 г., 20:208. |
| [59] | Хофманн А., Хёвелинг А. дои: 10.1002/celc.v6.20 |
| [60] | Xu G J, Pang C G, Chen B B, Ma J, Wang X, Chai J C, Wang Q F, An W Z, Zhou X H, Cui GL, Chen L Q. Adv. Энергетические мат., 2018, 8(9):1870038. дои: 10.1002/aenm.v8.9 |
| [61] | Lu D, Xu G J, Hu Z W, Cui Z L, Wang X, Li J D, Huang L, Du X F, Wang Y T, Ma J, Lu X L, Lin H J, Chen C T, Nugroho A A, Tjeng L H, Cui G L. Малые методы, 2019, 3(10):1 | 6.
| [62] | Чжао В.М., Чжэн Б.З., Лю Х.Д., Жэнь Ф.К., Чжу Дж.П., Чжэн Г.Р., Чен С.Дж., Лю Р., Ян Х.Р., Ян Ю. Нано Энергия, 2019, 63:103815. doi: 10.1016/j.nanoen.2019.06.011 |
| [63] | Beltrop K, Klein S, Nölle R, Wilken A, Lee JJ, Köster TKJ, Reiter J, Tao L, Liang CD, Winter M, Qi X, Placke T. doi: 10.1021/acs.chemmater.8b00413 |
| [64] | Yue H Y, Dong Z Y, Yang Y G, Han Z L, Wang L, Zhang H S, Yin Y H, Zhang X G, Zhang Z T, Yang S T. J. Colloid Interface Sci., 2020, 559: 236. doi: 10.1016/j.jcis.2019.10.002 |
| [65] | Zuo X X, Fan C J, Liu J S, Xiao X, Wu J H, Nan J M. J. Power Sources, 2013, 229:308. doi: 10.1016/j.jpowsour.2012.12.056 |
| [66] | Yu Q P, Chen Z T, Xing L D, Chen D R, Rong H B, Liu Q F, Li W S. Electrochimica Acta, 2015, 176:919. doi: 10.1016/j.electacta.2015.07.058 |
| [67] | Wang Z S, Xing L D, Li J H, Xu M Q, Li W S. J. Power Sources, 2016, 307:587. doi: 10.1016/j.jpowsour.2015.11.091 |
| [68] | Qin Z M, Hong S, Hong B, Duan B Y, Lai Y Q, Feng JJ Electroanal. doi: 10.1016/j.jelechem.2019.113506 |
| [69] | Liu Q Y, Yang G J, Liu S, Han M, Wang Z X, Chen L Q. Приложение ACS. Матер. Интерфейсы, 2019, 11(19):17435. дои: 10.1021/acsami.9b03417 |
| [70] | Yue H Y, Yang Y G, Xiao Y, Dong Z Y, Cheng S G, Yin Y H, Ling C, Yang W G, Yu Y H, Yang S T. J. Mater. хим. А, 2019, 7(2):594. дои: 10.1039/C8TA09380F |
| [71] | Dong Y N, Young B T, Zhang Y Z, Yoon T, Heskett DR, Hu Y F, Lucht B L. ACS Appl. Матер. Интерфейсы, 2017, 9(24):20467. дои: 10.1021/acsami.7b01481 |
| [72] | Шкроб И. А., Чжу Ю., Марин Т. В., Абрахам Д. П. J. Phys. хим. С, 2013, 117(45):23750. дои: 10.1021/jp407714p |
| [73] | Ha S Y, Han J G, Song Y M, Chun M J, Han S I, Shin WC, Choi N S. doi: 10.1016/j.electacta.2013.04.082 |
| [74] | Xu M Q, Zhou L, Dong Y N, Chen Y J, Garsuch A, Lucht B L. J. Electrochem. Соц., 2013, 160(11):A2005. дои: 10.1149/2.053311jes |
| [75] | Печонка Н. П. В., Ян Л., Балог М. П., Пауэлл Б. Р., Чемелевский К., Мантирам А., Крачковский С. А., Говард Г. Р., Лю М. Х., Ким Дж. Х. Дж. Phys. хим. С, 2013, 117(44):22603. дои: 10.1021/jp408717x |
| [76] | Ларуш-Асраф Л., Битон М., Теллер Х., Зиниград Э., Аурбах Д. Дж. Источники питания, 2007, 174(2):400. doi: 10.1016/j.jpowsour.2007.06.171 |
| [77] | Чжан С. С. Электрохим. Общ., 2006, 8:1423. doi: 10.1016/j.elecom.2006.06.016 |
| [78] | Чжан С. doi: 10.1016/j.jpowsour.2006.09.040 |
| [79] | Liu J, Chen ZH, Busking S, Amine K. Electrochem. Комм., 2007, 9(3):475. doi: 10.1016/j.elecom.2006.10.022 |
| [80] | Li J, Xie K Y, Lai Y Q, Zhang Z A, Li F Q, Hao X, Chen X J, Liu Y X. J. Power Sources, 2010, 195(16):5344. doi: 10.1016/j.jpowsour.2010.03.038 |
| [81] | Сюй М. К., Чжоу Л., Хао Л. С., Син Л. Д., Ли В. С., Лучт Б. Л. Дж. Источники питания, 2011, 196(16):6794. doi: 10.1016/j.jpowsour.2010.10.050 |
| [82] | Hu M, Wei J P, Xing L Y, Zhou Z. J. Appl. Электрохим., 2012, 42(5):291. doi: 10.1007/s10800-012-0398-0 |
| [83] | Ся Л. дои: 10.1021/acsomega.7b01196 |
| [84] | Zhuang Y, Lei Y Q, Guan M Y, Du F H, Cao H S, Dai H, Zhou Q, Adkins J, Zheng J W. Electrochimica Acta, 2020, 331:135465. doi: 10.1016/j.electacta.2019.135465 |
| [85] | Хамену Л., Мадзвамусе А., Мохаммед Л., Ли Ю. М., Ко Дж. М., Бон С. И., Ким С. Дж., Чо В. И., Пэк И. Г., Парк Дж. Дж. Инд. хим., 2017, 53:241. doi: 10.1016/j.jiec.2017.04.031 |
| [86] | Tu W Q, Xia P, Li J H, Zeng L Z, Xu M Q, Xing L D, Zhang L P, Yu L, Fan W Z, Li W S. Electrochimica Acta, 2016, 208:251. doi: 10.1016/j.electacta.2016.05.029 |
| [87] | Xia J, Harlow J E, Petibon R, Burns J C, Chen L P, Dahn J R. дои: 10.1149/2.049404jes |
| [88] | Бирроцци А., Лащински Н., Хекматфар М., фон Замори Дж., Гиффин Г. А., Пассерини С. Дж. Источники энергии, 2016, 325:525. doi: 10.1016/j.jpowsour.2016.06.054 |
| [89] | Пирес Дж., Тимперман Л., Кастетс А., Пенья Дж. С., Дюмон Э., Левассер С., Дедривер Р., Тессье С., Анути М. RSC Adv., 2015, 5(52):42088. дои: 10.1039/C5RA05650K |
| [90] | Хекматфар М., Хаса И., Эгбал Р., Карвалью Д. В., Моретти А., Пассерини С. Adv. Матер. Интерфейсы, 2020, 7(1):1 0.дои: 10.1002/адми.v7.1 |
| [91] | Ши С.Г., Шен С.Х., Пэн Х.С., Луо С.Х., Шен Л.Ф., Шэн В.Дж., Фан Дж.Дж., Ван Ц., Чжан С.Дж., Сюй Б.Б., Сиань Дж.Дж., Вэй Ю.М., Хуан Л. doi: 10.1016/j.nanoen.2019.104084 |
| [92] | Park E J, Kwon Y G, Yoon S, Cho K Y J Power Sources, 2019, 441:126668. doi: 10.1016/j.jpowsour.2019.05.074 |
| [93] | Сян Ф.Ю., Ван П.П., Ченг Х. Energy Technol., 2020, 8(5):17. дои: 10.1002/ente.v8.5 |
| [94] | Liu Q, Xu H L, Wu F, Mu DB, Shi L L, Wang L, Bi J Y, Wu B R. ACS Appl. Энергетические материи, 2019, 2(12):8878. дои: 10.1021/acsaem.9б01917 |
| [95] | Wu B R, Liu Q, Mu D B, Xu H L, Wang L, Shi L L, Gai L, Wu F. RSC Adv., 2016, 6(57):51738. дои: 10.1039/C6RA09480E |
| [96] | Yang T X, Zeng H N, Wang W L, Zhao X Y, Fan W Z, Wang C Y, Zuo X X, Zeng R H, Nan J M. дои: 10.1039/C9TA01293A |
| [97] | Хан Ю. К., Ю Дж., Йим Т. Electrochimica Acta, 2016, 215:455. doi: 10.1016/j.electacta.2016.08.131 |
| [98] | Zhang G, Musgrave C B. J. Phys. хим. А, 2007, 111(8):1554. пмид: 17279730 |
| [1] | Чжэн Чен, Чжэньхуа Цзян. Обсуждение некоторых химических проблем полимерного конденсированного состояния в безрастворительной технологии производства полимеров [Дж]. Успехи химии, 2022, 34(7): 1576-1589.. |
| [2] | Ру Цзян, Чэньсюй Лю, Пин Ян, Шули Ю. Химия конденсированного состояния в асимметричном катализе и синтезе [Дж]. Успехи химии, 2022, 34(7): 1537-1547. |
| [3] | Сюмин Ван, Шупинг Ли, Ренджи Хэ, Чуан Юй, Цзя Се, Шицзе Ченг. Квазитвердотельный механизм преобразования серных катодов
[Дж]. Успехи химии, 2022, 34(4): 909-925. Квазитвердотельный механизм преобразования серных катодов
[Дж]. Успехи химии, 2022, 34(4): 909-925. |
| [4] | Чуан Хэ, Шуан Э, Хунхао Ян, Сяоцзе Ли. Углеродные точки в смазочных системах [Дж]. Успехи химии, 2022, 34(2): 356-369. |
| [5] | Цайвэй Ван, Дунцзе Ян, Сюэцин Цю, Вэньли Чжан. Применение пористых углей, полученных из лигнина, для электрохимического накопления энергии [Дж]. Успехи химии, 2022, 34(2): 285-300. |
| [6] | Лонг Чен, Шаобо Хуан, Цзинъи Цю, Хао Чжан, Гаопин Цао. Интерфейс полимерный электролит/анод в твердотельной литиевой батарее [Дж]. Успехи химии, 2021, 33(8): 1378-1389. |
| [7] | Ян Чен, Сяоли Цуй. Анодные материалы из диоксида титана для литий-ионных аккумуляторов [Дж]. Успехи химии, 2021, 33(8): 1249-1269. |
| [8] | Цзяшэн Лу, Цзямяо Чен, Тяньсянь Хэ, Цзинвэй Чжао, Цзюнь Лю, Яньпин Хо. Неорганические твердые электролиты для литий-ионных аккумуляторов
[Дж]. Успехи химии, 2021, 33(8): 1344-1361. Неорганические твердые электролиты для литий-ионных аккумуляторов
[Дж]. Успехи химии, 2021, 33(8): 1344-1361. |
| [9] | Цзиньхуо Гао, Цзяфэн Жуань, Юэпэн Пан, Хао Сун, Цзюньхэ Ян, Шию Чжэн. Высокотемпературные свойства LiNi 0,5 Mn 1,5 O 4 в качестве катодных материалов для высоковольтных литий-ионных аккумуляторов [Дж]. Успехи химии, 2021, 33(8): 1390-1403. |
| [10] | Вентао Ли, Хай Чжун, Яохуа Май. Электролиты для полимеризации на месте для литиевых аккумуляторных батарей [Дж]. Успехи химии, 2021, 33(6): 988-997. |
| [11] | Юсен Дин, Пу Чжан, Хун Ли, Вэньхуань Чжу, Хао Вэй. Состояние исследований и перспективы Li-Se аккумуляторов [Дж]. Успехи химии, 2021, 33(4): 610-632. |
| [12] | Ци Ян, Наньпин Дэн, Боуэн Ченг, Вэйминь Кан. Гелевые полимерные электролиты в литиевых батареях
[Дж]. Успехи химии, 2021, 33(12): 2270-2282. Гелевые полимерные электролиты в литиевых батареях
[Дж]. Успехи химии, 2021, 33(12): 2270-2282. |
| [13] | И Чжан, Мэн Чжан, Ифан Тонг, Хайся Цуй, Панденг Ху, Вэйвэй Хуан. Применение мультикарбонильных ковалентных органических каркасов во вторичных батареях [Дж]. Успехи химии, 2021, 33(11): 2024-2032. |
| [14] | Ю Инь, Чуньхуэй Ма, Вэй Ли, Шоусин Лю. Система растворителей и механизм превращения препарата 5-гидроксиметилфурфурола из глюкозы [Дж]. Прогресс в химии, 2021, 33 (10): 1856-1873. |
| [15] | Дэчао Ван, Янъян Синь, Сяоцянь Ли, Дундонг Яо, Япин Чжэн. Пористые жидкости и их применение для улавливания и разделения газов [Дж]. Прогресс в химии, 2021, 33 (10): 1874-1886. |
| Просмотрено | ||
| Полный текст | | |
| Аннотация | | |
БУ-307: Как работает электролит?
Электролит служит катализатором для повышения проводимости батареи, способствуя перемещению ионов от катода к аноду при зарядке и обратно при разрядке. Ионы – это электрически заряженные атомы, которые потеряли или приобрели электроны. Электролит батареи состоит из растворимых солей, кислот или других оснований в жидком, гелеобразном и сухом виде. Электролит также поставляется в виде полимера, используемого в твердотельной батарее, твердой керамики и расплавленных солей, как в натрий-серной батарее.
Ионы – это электрически заряженные атомы, которые потеряли или приобрели электроны. Электролит батареи состоит из растворимых солей, кислот или других оснований в жидком, гелеобразном и сухом виде. Электролит также поставляется в виде полимера, используемого в твердотельной батарее, твердой керамики и расплавленных солей, как в натрий-серной батарее.
Свинцово-кислотный использует серную кислоту . При зарядке кислота становится более плотной, так как на положительной пластине образуется оксид свинца (PbO 2 ), который при полной разрядке превращается почти в воду. Удельный вес серной кислоты измеряют ареометром. (См. также BU-903: Как измерить уровень заряда). Свинцово-кислотные батареи выпускаются в залитых и герметичных форматах, также известных как свинцово-кислотные с регулируемым клапаном (VRLA) или необслуживаемые.
Серная кислота бесцветна с легким желто-зеленым оттенком, растворима в воде и обладает высокой коррозионной активностью. Изменение цвета на коричневатый оттенок может быть вызвано ржавлением в результате анодной коррозии или попаданием воды в аккумуляторную батарею.
Изменение цвета на коричневатый оттенок может быть вызвано ржавлением в результате анодной коррозии или попаданием воды в аккумуляторную батарею.
Свинцово-кислотные аккумуляторы имеют разный удельный вес (SG). В батареях глубокого цикла используется плотный электролит с SG до 1,330 для достижения высокой удельной энергии, стартерные батареи имеют средний SG около 1,265, а стационарные батареи имеют низкий SG около 1,225 для сдерживания коррозии и увеличения срока службы. (см. БУ-903: Как измерить уровень заряда).
Серная кислота имеет широкий спектр применений, а также входит в состав очистителей канализации и различных чистящих средств. Он также используется в переработке полезных ископаемых, производстве удобрений, переработке нефти, очистке сточных вод и химическом синтезе.
| ВНИМАНИЕ | Серная кислота может вызвать серьезные повреждения при попадании на кожу и привести к необратимой слепоте при попадании в глаза. Проглатывание серной кислоты вызывает необратимые повреждения. Проглатывание серной кислоты вызывает необратимые повреждения. |
Электролит в NiCd представляет собой щелочной электролит (гидроксид калия) . Большинство никель-кадмиевых аккумуляторов имеют цилиндрическую форму, в которой несколько слоев положительных и отрицательных материалов свернуты в рулон. Залитая версия NiCd используется в качестве корабельной батареи в коммерческих самолетах и в системах ИБП, работающих в жарком и холодном климате, требующих частых циклов. NiCd дороже свинцово-кислотных, но служит дольше.
Никель-металлогидридный (NiMH) NiMH использует тот же или аналогичный электролит, что и NiCd, который обычно представляет собой гидроксид калия. Электроды NiMH уникальны и состоят из никеля, кобальта, марганца, алюминия и редкоземельных металлов, которые также используются в литий-ионных батареях. NiMH доступен только в герметичных версиях.
Гидроксид калия представляет собой неорганическое соединение с формулой KOH, обычно называемое едким калием. Электролит бесцветен и имеет множество промышленных применений, например, ингредиент большинства мягких и жидких мыл. КОН вреден, если его не переварить.
Литий-ионный (Li-ion)Литий-ионный использует жидкий, гелевый или сухой полимерный электролит. Жидкая версия представляет собой легковоспламеняющийся органический, а не водный тип, раствор солей лития с органическими растворителями, подобными этиленкарбонату. Смешивание растворов с различными карбонатами обеспечивает более высокую проводимость и расширяет диапазон температур. Другие соли могут быть добавлены для уменьшения газообразования и улучшения цикличности при высоких температурах.
Литий-ионные аккумуляторы с гелеобразными электролитами получают множество добавок для повышения проводимости, то же самое относится и к литий-полимерным аккумуляторам. Настоящий сухой полимер становится проводящим только при повышенных температурах, и эта батарея больше не используется в коммерческих целях. Добавки также вводятся для достижения долговечности и уникальных характеристик. Рецепт засекречен и у каждого производителя есть свой секрет соуса. (См. также BU-808b: Из-за чего умирает литий-ионный аккумулятор?)
Добавки также вводятся для достижения долговечности и уникальных характеристик. Рецепт засекречен и у каждого производителя есть свой секрет соуса. (См. также BU-808b: Из-за чего умирает литий-ионный аккумулятор?)
Электролит должен быть стабильным, но это не относится к Li-ion. На аноде образуется пассивирующая пленка, называемая интерфейсом твердого электролита (SEI) . Этот слой отделяет анод от катода, но позволяет ионам проходить через него подобно сепаратору. По сути, слой SEI должен сформироваться, чтобы батарея могла работать. Пленка стабилизирует систему и продлевает срок службы литий-ионных аккумуляторов, но снижает емкость. На катоде также происходит окисление электролита, что необратимо снижает емкость. (См. также BU-701: Как заправить батареи)
Чтобы пленки не становились слишком ограничительными, добавки смешивают с электролитом, который расходуется при формировании слоя SEI. Трудно, если вообще возможно, отследить их присутствие при проведении судебно-медицинской экспертизы. Это держит запатентованные добавки в коммерческой тайне, как их состав, так и используемое количество.
Это держит запатентованные добавки в коммерческой тайне, как их состав, так и используемое количество.
Хорошо известной добавкой является виниленкарбонат (VC). Это химическое вещество увеличивает срок службы литий-ионных аккумуляторов, особенно при более высоких температурах, и поддерживает низкое внутреннее сопротивление по мере использования и старения. VC также поддерживает стабильную пленку SEI на аноде без неблагоприятных побочных эффектов окисления электролита на катоде (Aurbach et al.). Говорят, что академические и исследовательские сообщества отстают от производителей клеток в знаниях и выборе добавок, отсюда и большой секрет. (См. также «Добавки и их влияние на кулоновскую эффективность» в разделе BU-808b: Что заставляет Li-ion умирать?
Для большинства коммерческих литий-ионных аккумуляторов слой SEI разрушается при температуре элемента 75–90°C (167–194°F). Тип элемента и уровень заряда (SoC) влияют на пробой при повышенной температуре. Может возникнуть самонагрев, который может привести к тепловому разгону при неправильном охлаждении. Лабораторные тесты, проведенные на ячейках 18650, показали, что такое тепловое событие может развиваться в течение двух дней.
Лабораторные тесты, проведенные на ячейках 18650, показали, что такое тепловое событие может развиваться в течение двух дней.
Еще одной проблемой является воспламеняемость литий-ионного электролита, и проводятся эксперименты по получению негорючих или пониженно воспламеняющихся электролитов с помощью добавок или разработки неорганических ионных жидкостей. Также проводятся исследования по эксплуатации Li-ion при низких температурах. На момент написания ни один из этих электролитов не имел широкого коммерческого применения.
Высыхание или медленное превращение жидкого электролита в твердую форму — еще одно явление старения, снижающее производительность Li-ion. «Когда жидкость ушла, батареи разряжены», — говорит Джефф Дан, специалист по литий-ионным батареям и профессор физики. Жидкость электролита — еще один индикатор состояния, относящийся ко всем химическим веществам батареи.
Аккумуляторы в портативном мире
Материалы по Battery University основаны на обязательном новом 4-м издании « Аккумуляторы в портативном мире — Справочник по перезаряжаемым батареям для не инженеров », который можно заказать на Amazon. com.
com.
Литий-ионная батарея — Институт чистой энергии
Как это работает?Литий-ионный (Li-ion) аккумулятор представляет собой передовую технологию аккумуляторов, в которой ионы лития используются в качестве ключевого компонента его электрохимии.Во время цикла разрядки атомы лития в аноде ионизируются и разделяются от своих электронов. Ионы лития движутся от анода и проходят через электролит, пока не достигнут катода, где они рекомбинируют со своими электронами и электрически нейтрализуются. Ионы лития достаточно малы, чтобы иметь возможность проходить через микропроницаемый разделитель между анод и катод.Отчасти из-за небольшого размера лития (уступая только водороду и гелию) литий-ионные батареи способны иметь очень высокое напряжение и запас заряда на единицу t масса и единица объема.
В литий-ионных батареях в качестве электродов могут использоваться различные материалы. Наиболее распространенной комбинацией является комбинация оксида лития-кобальта (катод) и графита (анод), которая чаще всего встречается в портативных электронных устройствах, таких как мобильные телефоны и ноутбуки. Другие катодные материалы включают оксид лития-марганца (используемый в гибридных электрических и электрических автомобилях) и фосфат лития-железа. В литий-ионных батареях в качестве электролита обычно используется эфир (класс органических соединений).
Другие катодные материалы включают оксид лития-марганца (используемый в гибридных электрических и электрических автомобилях) и фосфат лития-железа. В литий-ионных батареях в качестве электролита обычно используется эфир (класс органических соединений).
Применение аккумуляторов
Математические модели эффективности батарей
Каковы некоторые преимущества литий-ионных батарей? По сравнению с другими высококачественными аккумуляторами (никель-кадмиевыми или никель-металлогидридными) литий-ионные аккумуляторы имеют ряд преимуществ. У них одна из самых высоких плотностей энергии среди аккумуляторных технологий на сегодняшний день (100-265 Втч/кг или 250-670 Втч/л). Кроме того, литий-ионные аккумуляторные элементы могут выдавать напряжение до 3,6 В, что в 3 раза выше, чем у таких технологий, как Ni-Cd или Ni-MH. Это означает, что они могут обеспечивать большое количество тока для мощных приложений, в которых литий-ионные батареи также сравнительно просты в обслуживании и не требуют плановых циклов для продления срока службы батареи. Литий-ионные аккумуляторы не имеют эффекта памяти, пагубного процесса, при котором повторяющиеся циклы частичной разрядки/зарядки могут привести к тому, что аккумулятор «запомнит» более низкую емкость. Это преимущество как перед Ni-Cd, так и перед Ni-MH, которые проявляют этот эффект. Литий-ионные аккумуляторы также имеют низкую скорость саморазряда, составляющую около 1,5-2% в месяц. Они не содержат токсичного кадмия, что облегчает их утилизацию по сравнению с Ni-Cd батареями.
У них одна из самых высоких плотностей энергии среди аккумуляторных технологий на сегодняшний день (100-265 Втч/кг или 250-670 Втч/л). Кроме того, литий-ионные аккумуляторные элементы могут выдавать напряжение до 3,6 В, что в 3 раза выше, чем у таких технологий, как Ni-Cd или Ni-MH. Это означает, что они могут обеспечивать большое количество тока для мощных приложений, в которых литий-ионные батареи также сравнительно просты в обслуживании и не требуют плановых циклов для продления срока службы батареи. Литий-ионные аккумуляторы не имеют эффекта памяти, пагубного процесса, при котором повторяющиеся циклы частичной разрядки/зарядки могут привести к тому, что аккумулятор «запомнит» более низкую емкость. Это преимущество как перед Ni-Cd, так и перед Ni-MH, которые проявляют этот эффект. Литий-ионные аккумуляторы также имеют низкую скорость саморазряда, составляющую около 1,5-2% в месяц. Они не содержат токсичного кадмия, что облегчает их утилизацию по сравнению с Ni-Cd батареями.
Благодаря этим преимуществам литий-ионные аккумуляторы вытеснили никель-кадмиевые аккумуляторы и заняли лидирующие позиции на рынке портативных электронных устройств (таких как смартфоны и ноутбуки). Литий-ионные батареи также используются для питания электрических систем в некоторых аэрокосмических приложениях, в частности в новом и более экологичном Боинге 787, где вес является значительным фактором стоимости. С точки зрения экологически чистой энергии большая часть перспектив литий-ионных технологий исходит из их потенциального применения в автомобилях с батарейным питанием. В настоящее время самые продаваемые электромобили Nissan Leaf и Tesla Model S используют литий-ионные аккумуляторы в качестве основного источника топлива.
Литий-ионные батареи также используются для питания электрических систем в некоторых аэрокосмических приложениях, в частности в новом и более экологичном Боинге 787, где вес является значительным фактором стоимости. С точки зрения экологически чистой энергии большая часть перспектив литий-ионных технологий исходит из их потенциального применения в автомобилях с батарейным питанием. В настоящее время самые продаваемые электромобили Nissan Leaf и Tesla Model S используют литий-ионные аккумуляторы в качестве основного источника топлива.
Несмотря на свои технологические перспективы, литий-ионные аккумуляторы по-прежнему имеют ряд недостатков, особенно в отношении безопасности. Литий-ионные аккумуляторы имеют тенденцию к перегреву и могут быть повреждены при высоких напряжениях. В некоторых случаях это может привести к тепловому разгону и возгоранию. Это вызвало серьезные проблемы, в частности, остановку парка самолетов Boeing 787 после того, как поступили сообщения о возгорании бортовых батарей. Из-за рисков, связанных с этими батареями, ряд транспортных компаний отказываются выполнять массовые перевозки батарей самолетами. Для литий-ионных аккумуляторов требуются защитные механизмы для ограничения напряжения и внутреннего давления, что в некоторых случаях может увеличить вес и ограничить производительность. Литий-ионные аккумуляторы также подвержены старению, а это означает, что они могут терять емкость и часто выходят из строя через несколько лет. Еще одним фактором, ограничивающим их широкое распространение, является их стоимость, которая примерно на 40% выше, чем у Ni-Cd. Решение этих проблем является ключевым компонентом текущих исследований в области технологии. Наконец, несмотря на высокую плотность энергии литий-ионных аккумуляторов по сравнению с другими типами аккумуляторов, они по-прежнему имеют примерно в сто раз меньшую плотность энергии, чем бензин (который содержит 12 700 Втч/кг по массе или 8760 Втч/л по объему).
Из-за рисков, связанных с этими батареями, ряд транспортных компаний отказываются выполнять массовые перевозки батарей самолетами. Для литий-ионных аккумуляторов требуются защитные механизмы для ограничения напряжения и внутреннего давления, что в некоторых случаях может увеличить вес и ограничить производительность. Литий-ионные аккумуляторы также подвержены старению, а это означает, что они могут терять емкость и часто выходят из строя через несколько лет. Еще одним фактором, ограничивающим их широкое распространение, является их стоимость, которая примерно на 40% выше, чем у Ni-Cd. Решение этих проблем является ключевым компонентом текущих исследований в области технологии. Наконец, несмотря на высокую плотность энергии литий-ионных аккумуляторов по сравнению с другими типами аккумуляторов, они по-прежнему имеют примерно в сто раз меньшую плотность энергии, чем бензин (который содержит 12 700 Втч/кг по массе или 8760 Втч/л по объему).
Вклады CEI
Основные результаты исследований
Одним из способов, которым CEI работала для достижения этой цели, является прямое изображение, в частности, с использованием рентгеновской спектроскопии. Недавно в лаборатории профессора Джерри Зайдлера был разработан метод проведения рентгеновской спектроскопии ближней краевой структуры (XANES) на рабочем столе. Этот метод может позволить относительно подробные измерения определенных характеристик внутреннего состояния батареи без необходимости вскрывать ее и, таким образом, нарушать работу системы. Раньше XANES можно было реализовать только с чрезвычайно высоким потоком излучения от таких инструментов, как синхротрон. Это чрезвычайно большие и дорогие установки стоимостью до 1 миллиарда долларов, которые пользуются таким большим спросом среди ученых, что многомесячные списки ожидания становятся нормой. Используя преимущества новых передовых оптических технологий, лаборатория Зайдлера смогла изготовить небольшой прибор стоимостью 25 000 долларов, который может имитировать измерения, проводимые на синхротроне. С помощью этого нового инструмента ученые могут получать результаты в течение нескольких часов без значительного времени ожидания, что значительно увеличивает скорость разработки нестандартных технологий.
Недавно в лаборатории профессора Джерри Зайдлера был разработан метод проведения рентгеновской спектроскопии ближней краевой структуры (XANES) на рабочем столе. Этот метод может позволить относительно подробные измерения определенных характеристик внутреннего состояния батареи без необходимости вскрывать ее и, таким образом, нарушать работу системы. Раньше XANES можно было реализовать только с чрезвычайно высоким потоком излучения от таких инструментов, как синхротрон. Это чрезвычайно большие и дорогие установки стоимостью до 1 миллиарда долларов, которые пользуются таким большим спросом среди ученых, что многомесячные списки ожидания становятся нормой. Используя преимущества новых передовых оптических технологий, лаборатория Зайдлера смогла изготовить небольшой прибор стоимостью 25 000 долларов, который может имитировать измерения, проводимые на синхротроне. С помощью этого нового инструмента ученые могут получать результаты в течение нескольких часов без значительного времени ожидания, что значительно увеличивает скорость разработки нестандартных технологий.
Другой аспект исследования аккумуляторов CEI включает создание физических, математических и вычислительных моделей внутреннего состояния аккумулятора. Это может помочь оптимизировать производительность батареи и циклы зарядки/разрядки, а также прогнозировать и предотвращать опасные отказы батареи. Профессор Венкат Субраманян, руководитель Лаборатории моделирования, анализа и управления технологическими процессами для электрохимических систем (MAPLE), разрабатывает и переформулирует физические модели батарей, а также работает над методами моделирования и решения этих моделей с большей эффективностью и точностью. Создав более эффективную, универсальную и точную модель технологии литий-ионных аккумуляторов, M.A.P.L.E. Исследования лаборатории могут помочь в разработке аккумуляторов более точно для более безопасной и эффективной работы.
Другие направления Большая часть текущих исследований CEI направлена на разработку способов лучшего понимания и управления важными внутренними состояниями литий-ионных аккумуляторов. Понимание внутренней работы батареи имеет важное значение для улучшения конструкции и оценки режимов ее отказа.
Понимание внутренней работы батареи имеет важное значение для улучшения конструкции и оценки режимов ее отказа.
Другим крупным направлением исследований CEI является разработка новых материалов для улучшения характеристик аккумуляторов. В центре внимания CEI находятся как наука о материалах высокого уровня, такая как разработка и замена альтернативных материалов в литий-ионных батареях, так и характеристика и проектирование наноструктурированных материалов или материалов, свойства которых определяются даже с точностью до нанометра. . Исследователи CEI также изучают материалы, которые могут предложить альтернативу технологиям литий-ионных аккумуляторов.
Кремний исследуется в качестве анодного материала, поскольку он может образовывать трехмерную клетку, обладающую большей способностью поглощать литий.
Узнать больше
- Веб-сайт, посвященный батареям и их повторному использованию, создан студентом REU Alek Lazarski «Мост чистой энергии»
- На веб-странице исследовательской группы Субраманиана есть свежие публикации о нелинейном прогнозирующем управлении с помощью моделей для литий-ионных аккумуляторов и других электрохимических систем.



