| Оксид азота(I) | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(I) |
| Химическая формула | N2O |
| Отн. молек. масса | 44 а. е. м. |
| Молярная масса | 44,0128 г/моль г/моль |
| Физические свойства | |
| Плотность вещества | 1222.8 кг/м-3 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | -90.86 °C (182.29 K) °C |
| Температура кипения | -88. |
| Классификация | |
| номер CAS | 10024-97-2 |
| (оксид диазота, закись азота, веселящий газ, лат. Nitrogenium охуdulatum) — соединение с химической формулой N2O. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. Всё семейство оксидов азота смотрите в статье оксиды азота.
ПолучениеЗакись азота получают нагреванием сухого нитрата аммония. NH4NO3 → N2O↑ + 2H2O. Более удобным способом является нагревание сульфаминовой кислоты с 73%-ной азотной кислотой: NH2SO2OH + HNO3 (73 %) → N2O↑ + SO2(OH)2 + H2O. Также можно взять концентрированную HNO3 и нашатырный спирт, смешать и нагреть. Физические свойстваВпервые был получен в 1799 г. Гемфри Дэви. Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2  Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны.Химические свойстваОтносится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя: N2O + H2 → N2↑ + H2O; N2O + C → N2↑ + CO↑. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя: 5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O. При нагревании N 2O разлагается: 2N2O → 2N2↑ + O2↑. ПрименениеИспользуется в основном как средство для ингаляционного наркоза, в основном в сочетании с другими препаратами (из-за недостаточно сильного обезболивающего действия). Средство для ингаляционного наркозаМалые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений. Закись азота обладает слабой наркотической активностью, в связи с чем её необходимо применять в больших концентрациях. В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами. Закись азота не вызывает раздражения дыхательных путей. Будучи, в процессе вдыхания, растворенной в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. Наркоз с применением закиси азота используется в хирургической практике, оперативной гинекологии, хирургической стоматологии, а также для обезболивания родов. «Лечебный анальгетический наркоз» (Б. В. Петровский, С. Н. Ефуни) с использованием смеси закиси азота и кислорода иногда применяют в послеоперационном периоде для профилактики травматического шока, а также для купирования болевых приступов при острой коронарной недостаточности, инфаркте миокарда, остром панкреатите и других патологических состояниях, сопровождающихся болями, не купирующимися обычными средствами. Применяют закись азота в смеси с кислородом при помощи специальных аппаратов для газового наркоза. Обычно начинают со смеси, содержащей 70—80 % закиси азота и 30—20 % кислорода, затем количество кислорода увеличивают до 40—50 %. Если не удается получить необходимую глубину наркоза, при концентрации закиси азота 70—75 %, добавляют более мощные наркотические средства: фторотан, эфир, барбитураты. Для более полного расслабления мускулатуры применяют миорелаксанты, при этом не только усиливается расслабление мышц, но также улучшается течение наркоза. После прекращения подачи закиси азота следует во избежание гипоксии продолжать давать кислород в течение 4—5 мин. Применять закись азота, как и любое средство для наркоза, необходимо с осторожностью, особенно при выраженных явлениях гипоксии и нарушении диффузии газов в лёгких. Для обезболивания родов пользуются методом прерывистой аутоанальгезии с применением, при помощи специальных наркозных аппаратов, смеси закиси азота (40—75 %) и кислорода. Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончанию. Для уменьшения эмоционального возбуждения, предупреждения тошноты и рвоты и потенцирования действия закиси азота возможна премедикация внутримышечным введением 0,5%-го раствора диазепама (седуксена, сибазона) в количестве 1—2 мл (5—10 мг), 2—3 мл 0,25%-го раствора дроперидола (5,0—7,5 мг). Лечебный наркоз закисью азота (при стенокардии и инфаркте миокарда) противопоказан при тяжёлых заболеваниях нервной системы, хроническом алкоголизме, состоянии алкогольного опьянения (возможны возбуждение, галлюцинации). Форма выпуска: в металлических баллонах вместимостью 10 л под давлением 50 атм в сжиженном состоянии. Баллоны окрашены в серый цвет и имеют надпись «Для медицинского применения». В двигателях внутреннего сгоранияЗакись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
См. подробнее: Системы закиси азота. В пищевой промышленностиВ пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ. ХранениеХранение: при комнатной температуре в закрытом помещении, вдали от огня. Ссылки
Wikimedia Foundation. 2010. Нужен реферат?
Полезное | |
| Оксид азота(I) | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(I) |
| Химическая формула | N2O |
Отн. молек. масса молек. масса | 44 а. е. м. |
| Молярная масса | 44,0128 г/моль г/моль |
| Физические свойства | |
| Плотность вещества | 1222.8 кг/м-3 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | -90.86 °C (182.29 K) °C |
| Температура кипения | -88.48 °C (184.67 K) °C |
| номер CAS | 10024-97-2 |
(оксид диазота, закись азота, веселящий газ, лат. Nitrogenium охуdulatum) — соединение с химической формулой N2O. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.Всё семейство оксидов азота смотрите в статье оксиды азота.
ПолучениеЗакись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 град по Цельсию и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, при температурах более 300 °C разлагается со взрывом: NH4NO3 → N2O↑ + 2H2O. Более удобным способом является нагревание сульфаминовой кислоты с 73%-ной азотной кислотой: NH2SO2OH + HNO3 (73 %) → N2O↑ + SO2(OH)2 + H2O. Также можно взять концентрированную HNO3 и нашатырный спирт, смешать и нагреть. Физические свойстваВпервые был получен в 1799 г. Гемфри Дэви. Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2O в 1 объёме воды при 25 °C). При 0 °C и давлении 30 атм, а также при комнатной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны. Химические свойстваОтносится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя: N2O + H2 → N2↑ + H2O; N2O + C → N2↑ + CO↑. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя: 5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O. При нагревании N2O разлагается: 2N2O → 2N2↑ + O2↑. ПрименениеИспользуется в основном как средство для ингаляционного наркоза, в основном в сочетании с другими препаратами (из-за недостаточно сильного обезболивающего действия). В то же время это соединение можно назвать самым безопасным средством для наркоза, так как после его применения почти не бывает осложнений. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. Средство для ингаляционного наркозаМалые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений. Закись азота обладает слабой наркотической активностью, в связи с чем её необходимо применять в больших концентрациях. Закись азота не вызывает раздражения дыхательных путей. Будучи, в процессе вдыхания, растворенной в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде. Наркоз с применением закиси азота используется в хирургической практике, оперативной гинекологии, хирургической стоматологии, а также для обезболивания родов. «Лечебный анальгетический наркоз» (Б. В. Петровский, С. Н. Ефуни) с использованием смеси закиси азота и кислорода иногда применяют в послеоперационном периоде для профилактики травматического шока, а также для купирования болевых приступов при острой коронарной недостаточности, инфаркте миокарда, остром панкреатите и других патологических состояниях, сопровождающихся болями, не купирующимися обычными средствами. Применяют закись азота в смеси с кислородом при помощи специальных аппаратов для газового наркоза. Обычно начинают со смеси, содержащей 70—80 % закиси азота и 30—20 % кислорода, затем количество кислорода увеличивают до 40—50 %. Если не удается получить необходимую глубину наркоза, при концентрации закиси азота 70—75 %, добавляют более мощные наркотические средства: фторотан, эфир, барбитураты. Для более полного расслабления мускулатуры применяют миорелаксанты, при этом не только усиливается расслабление мышц, но также улучшается течение наркоза. После прекращения подачи закиси азота следует во избежание гипоксии продолжать давать кислород в течение 4—5 мин. Применять закись азота, как и любое средство для наркоза, необходимо с осторожностью, особенно при выраженных явлениях гипоксии и нарушении диффузии газов в лёгких. Для обезболивания родов пользуются методом прерывистой аутоанальгезии с применением, при помощи специальных наркозных аппаратов, смеси закиси азота (40—75 %) и кислорода. Для уменьшения эмоционального возбуждения, предупреждения тошноты и рвоты и потенцирования действия закиси азота возможна премедикация внутримышечным введением 0,5%-го раствора диазепама (седуксена, сибазона) в количестве 1—2 мл (5—10 мг), 2—3 мл 0,25%-го раствора дроперидола (5,0—7,5 мг). Лечебный наркоз закисью азота (при стенокардии и инфаркте миокарда) противопоказан при тяжёлых заболеваниях нервной системы, хроническом алкоголизме, состоянии алкогольного опьянения (возможны возбуждение, галлюцинации). Форма выпуска: в металлических баллонах вместимостью 10 л под давлением 50 атм в сжиженном состоянии. Баллоны окрашены в серый цвет и имеют надпись «Для медицинского применения». В двигателях внутреннего сгоранияЗакись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
См. подробнее: Системы закиси азота. В пищевой промышленностиВ пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ. ХранениеХранение: при комнатной температуре в закрытом помещении, вдали от огня. Ссылки
Wikimedia Foundation. 2010. Нужен реферат?
Полезное | |
| Оксид азота(I) | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(I) |
| Химическая формула | N2O |
Отн. молек. масса молек. масса | 44 а. е. м. |
| Молярная масса | 44,0128 г/моль г/моль |
| Физические свойства | |
| Плотность вещества | 1222.8 кг/м-3 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | -90.86 °C (182.29 K) °C |
| Температура кипения | -88.48 °C (184.67 K) °C |
| Классификация | |
| номер CAS | 10024-97-2 |
(оксид диазота, закись азота, веселящий газ, лат. Nitrogenium охуdulatum) — соединение с химической формулой N2O. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.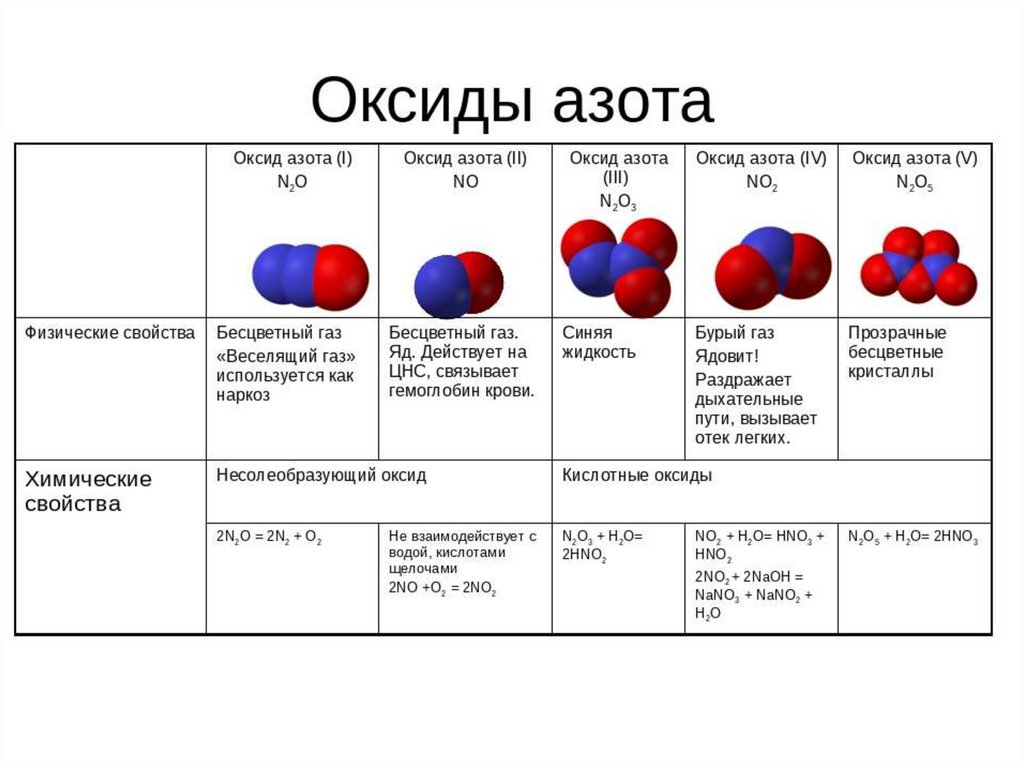 Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.Всё семейство оксидов азота смотрите в статье оксиды азота.
ПолучениеЗакись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 град по Цельсию и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, при температурах более 300 °C разлагается со взрывом: NH4NO3 → N2O↑ + 2H2O. Более удобным способом является нагревание сульфаминовой кислоты с 73%-ной азотной кислотой: NH2SO2OH + HNO3 (73 %) → N2O↑ + SO2(OH)2 + H2O. Также можно взять концентрированную HNO3 и нашатырный спирт, смешать и нагреть. Физические свойстваВпервые был получен в 1799 г. Гемфри Дэви. Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2O в 1 объёме воды при 25 °C). При 0 °C и давлении 30 атм, а также при комнатной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны. Химические свойстваОтносится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя: N2O + H2 → N2↑ + H2O; N2O + C → N2↑ + CO↑. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя: 5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O. При нагревании N2O разлагается: 2N2O → 2N2↑ + O2↑. ПрименениеИспользуется в основном как средство для ингаляционного наркоза, в основном в сочетании с другими препаратами (из-за недостаточно сильного обезболивающего действия). В то же время это соединение можно назвать самым безопасным средством для наркоза, так как после его применения почти не бывает осложнений. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. Средство для ингаляционного наркозаМалые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений. Закись азота обладает слабой наркотической активностью, в связи с чем её необходимо применять в больших концентрациях. Закись азота не вызывает раздражения дыхательных путей. Будучи, в процессе вдыхания, растворенной в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде. Наркоз с применением закиси азота используется в хирургической практике, оперативной гинекологии, хирургической стоматологии, а также для обезболивания родов. «Лечебный анальгетический наркоз» (Б. В. Петровский, С. Н. Ефуни) с использованием смеси закиси азота и кислорода иногда применяют в послеоперационном периоде для профилактики травматического шока, а также для купирования болевых приступов при острой коронарной недостаточности, инфаркте миокарда, остром панкреатите и других патологических состояниях, сопровождающихся болями, не купирующимися обычными средствами. Применяют закись азота в смеси с кислородом при помощи специальных аппаратов для газового наркоза. Обычно начинают со смеси, содержащей 70—80 % закиси азота и 30—20 % кислорода, затем количество кислорода увеличивают до 40—50 %. Если не удается получить необходимую глубину наркоза, при концентрации закиси азота 70—75 %, добавляют более мощные наркотические средства: фторотан, эфир, барбитураты. Для более полного расслабления мускулатуры применяют миорелаксанты, при этом не только усиливается расслабление мышц, но также улучшается течение наркоза. После прекращения подачи закиси азота следует во избежание гипоксии продолжать давать кислород в течение 4—5 мин. Применять закись азота, как и любое средство для наркоза, необходимо с осторожностью, особенно при выраженных явлениях гипоксии и нарушении диффузии газов в лёгких. Для обезболивания родов пользуются методом прерывистой аутоанальгезии с применением, при помощи специальных наркозных аппаратов, смеси закиси азота (40—75 %) и кислорода. Для уменьшения эмоционального возбуждения, предупреждения тошноты и рвоты и потенцирования действия закиси азота возможна премедикация внутримышечным введением 0,5%-го раствора диазепама (седуксена, сибазона) в количестве 1—2 мл (5—10 мг), 2—3 мл 0,25%-го раствора дроперидола (5,0—7,5 мг). Лечебный наркоз закисью азота (при стенокардии и инфаркте миокарда) противопоказан при тяжёлых заболеваниях нервной системы, хроническом алкоголизме, состоянии алкогольного опьянения (возможны возбуждение, галлюцинации). Форма выпуска: в металлических баллонах вместимостью 10 л под давлением 50 атм в сжиженном состоянии. Баллоны окрашены в серый цвет и имеют надпись «Для медицинского применения». В двигателях внутреннего сгоранияЗакись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
См. подробнее: Системы закиси азота. В пищевой промышленностиВ пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ. ХранениеХранение: при комнатной температуре в закрытом помещении, вдали от огня. Ссылки
Wikimedia Foundation. 2010. Нужно решить контрольную?
Полезное | |
| Оксид азота(I) | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(I) |
| Химическая формула | N2O |
Отн. молек. масса молек. масса | 44 а. е. м. |
| Молярная масса | 44,0128 г/моль г/моль |
| Физические свойства | |
| Плотность вещества | 1222.8 кг/м-3 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | -90.86 °C (182.29 K) °C |
| Температура кипения | -88.48 °C (184.67 K) °C |
| Классификация | |
| номер CAS | 10024-97-2 |
(оксид диазота, закись азота, веселящий газ, лат. Nitrogenium охуdulatum) — соединение с химической формулой N2O. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.Всё семейство оксидов азота смотрите в статье оксиды азота.
ПолучениеЗакись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 град по Цельсию и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, при температурах более 300 °C разлагается со взрывом: NH4NO3 → N2O↑ + 2H2O. Более удобным способом является нагревание сульфаминовой кислоты с 73%-ной азотной кислотой: NH2SO2OH + HNO3 (73 %) → N2O↑ + SO2(OH)2 + H2O. Также можно взять концентрированную HNO3 и нашатырный спирт, смешать и нагреть. Физические свойстваВпервые был получен в 1799 г. Гемфри Дэви. Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2O в 1 объёме воды при 25 °C). При 0 °C и давлении 30 атм, а также при комнатной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны. Химические свойстваОтносится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя: N2O + H2 → N2↑ + H2O; N2O + C → N2↑ + CO↑. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя: 5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O. При нагревании N2O разлагается: 2N2O → 2N2↑ + O2↑. ПрименениеИспользуется в основном как средство для ингаляционного наркоза, в основном в сочетании с другими препаратами (из-за недостаточно сильного обезболивающего действия). В то же время это соединение можно назвать самым безопасным средством для наркоза, так как после его применения почти не бывает осложнений. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. Средство для ингаляционного наркозаМалые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений. Закись азота обладает слабой наркотической активностью, в связи с чем её необходимо применять в больших концентрациях. Закись азота не вызывает раздражения дыхательных путей. Будучи, в процессе вдыхания, растворенной в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде. Наркоз с применением закиси азота используется в хирургической практике, оперативной гинекологии, хирургической стоматологии, а также для обезболивания родов. «Лечебный анальгетический наркоз» (Б. В. Петровский, С. Н. Ефуни) с использованием смеси закиси азота и кислорода иногда применяют в послеоперационном периоде для профилактики травматического шока, а также для купирования болевых приступов при острой коронарной недостаточности, инфаркте миокарда, остром панкреатите и других патологических состояниях, сопровождающихся болями, не купирующимися обычными средствами. Применяют закись азота в смеси с кислородом при помощи специальных аппаратов для газового наркоза. Обычно начинают со смеси, содержащей 70—80 % закиси азота и 30—20 % кислорода, затем количество кислорода увеличивают до 40—50 %. Если не удается получить необходимую глубину наркоза, при концентрации закиси азота 70—75 %, добавляют более мощные наркотические средства: фторотан, эфир, барбитураты. Для более полного расслабления мускулатуры применяют миорелаксанты, при этом не только усиливается расслабление мышц, но также улучшается течение наркоза. После прекращения подачи закиси азота следует во избежание гипоксии продолжать давать кислород в течение 4—5 мин. Применять закись азота, как и любое средство для наркоза, необходимо с осторожностью, особенно при выраженных явлениях гипоксии и нарушении диффузии газов в лёгких. Для обезболивания родов пользуются методом прерывистой аутоанальгезии с применением, при помощи специальных наркозных аппаратов, смеси закиси азота (40—75 %) и кислорода. Для уменьшения эмоционального возбуждения, предупреждения тошноты и рвоты и потенцирования действия закиси азота возможна премедикация внутримышечным введением 0,5%-го раствора диазепама (седуксена, сибазона) в количестве 1—2 мл (5—10 мг), 2—3 мл 0,25%-го раствора дроперидола (5,0—7,5 мг). Лечебный наркоз закисью азота (при стенокардии и инфаркте миокарда) противопоказан при тяжёлых заболеваниях нервной системы, хроническом алкоголизме, состоянии алкогольного опьянения (возможны возбуждение, галлюцинации). Форма выпуска: в металлических баллонах вместимостью 10 л под давлением 50 атм в сжиженном состоянии. Баллоны окрашены в серый цвет и имеют надпись «Для медицинского применения». В двигателях внутреннего сгоранияЗакись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
См. подробнее: Системы закиси азота. В пищевой промышленностиВ пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ. ХранениеХранение: при комнатной температуре в закрытом помещении, вдали от огня. Ссылки
Wikimedia Foundation. 2010. Нужно решить контрольную?
Полезное | |
| Оксид азота(I) | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(I) |
| Химическая формула | N2O |
Отн. молек. масса молек. масса | 44 а. е. м. |
| Молярная масса | 44,0128 г/моль г/моль |
| Физические свойства | |
| Плотность вещества | 1222.8 кг/м-3 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | -90.86 °C (182.29 K) °C |
| Температура кипения | -88.48 °C (184.67 K) °C |
| Классификация | |
| номер CAS | 10024-97-2 |
(оксид диазота, закись азота, веселящий газ, лат. Nitrogenium охуdulatum) — соединение с химической формулой N2O. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта.Всё семейство оксидов азота смотрите в статье оксиды азота.
ПолучениеЗакись азота получают нагреванием сухого нитрата аммония. Разложение начинается при 170 град по Цельсию и сопровождается выделением тепла. Поэтому, чтобы не дать протекать ему слишком бурно, следует вовремя прекратить нагревание, при температурах более 300 °C разлагается со взрывом: NH4NO3 → N2O↑ + 2H2O. Более удобным способом является нагревание сульфаминовой кислоты с 73%-ной азотной кислотой: NH2SO2OH + HNO3 (73 %) → N2O↑ + SO2(OH)2 + H2O. Также можно взять концентрированную HNO3 и нашатырный спирт, смешать и нагреть. Физические свойстваВпервые был получен в 1799 г. Гемфри Дэви. Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде (0,6 объёма N2O в 1 объёме воды при 25 °C). При 0 °C и давлении 30 атм, а также при комнатной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение. Смеси с эфиром, циклопропаном, хлорэтилом в определённых концентрациях взрывоопасны. Химические свойстваОтносится к несолеобразующим оксидам. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя: N2O + H2 → N2↑ + H2O; N2O + C → N2↑ + CO↑. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя: 5N2О + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O. При нагревании N2O разлагается: 2N2O → 2N2↑ + O2↑. ПрименениеИспользуется в основном как средство для ингаляционного наркоза, в основном в сочетании с другими препаратами (из-за недостаточно сильного обезболивающего действия). В то же время это соединение можно назвать самым безопасным средством для наркоза, так как после его применения почти не бывает осложнений. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. Средство для ингаляционного наркозаМалые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия. В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений. Закись азота обладает слабой наркотической активностью, в связи с чем её необходимо применять в больших концентрациях. Закись азота не вызывает раздражения дыхательных путей. Будучи, в процессе вдыхания, растворенной в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде. Наркоз с применением закиси азота используется в хирургической практике, оперативной гинекологии, хирургической стоматологии, а также для обезболивания родов. «Лечебный анальгетический наркоз» (Б. В. Петровский, С. Н. Ефуни) с использованием смеси закиси азота и кислорода иногда применяют в послеоперационном периоде для профилактики травматического шока, а также для купирования болевых приступов при острой коронарной недостаточности, инфаркте миокарда, остром панкреатите и других патологических состояниях, сопровождающихся болями, не купирующимися обычными средствами. Применяют закись азота в смеси с кислородом при помощи специальных аппаратов для газового наркоза. Обычно начинают со смеси, содержащей 70—80 % закиси азота и 30—20 % кислорода, затем количество кислорода увеличивают до 40—50 %. Если не удается получить необходимую глубину наркоза, при концентрации закиси азота 70—75 %, добавляют более мощные наркотические средства: фторотан, эфир, барбитураты. Для более полного расслабления мускулатуры применяют миорелаксанты, при этом не только усиливается расслабление мышц, но также улучшается течение наркоза. После прекращения подачи закиси азота следует во избежание гипоксии продолжать давать кислород в течение 4—5 мин. Применять закись азота, как и любое средство для наркоза, необходимо с осторожностью, особенно при выраженных явлениях гипоксии и нарушении диффузии газов в лёгких. Для обезболивания родов пользуются методом прерывистой аутоанальгезии с применением, при помощи специальных наркозных аппаратов, смеси закиси азота (40—75 %) и кислорода. Для уменьшения эмоционального возбуждения, предупреждения тошноты и рвоты и потенцирования действия закиси азота возможна премедикация внутримышечным введением 0,5%-го раствора диазепама (седуксена, сибазона) в количестве 1—2 мл (5—10 мг), 2—3 мл 0,25%-го раствора дроперидола (5,0—7,5 мг). Лечебный наркоз закисью азота (при стенокардии и инфаркте миокарда) противопоказан при тяжёлых заболеваниях нервной системы, хроническом алкоголизме, состоянии алкогольного опьянения (возможны возбуждение, галлюцинации). Форма выпуска: в металлических баллонах вместимостью 10 л под давлением 50 атм в сжиженном состоянии. Баллоны окрашены в серый цвет и имеют надпись «Для медицинского применения». В двигателях внутреннего сгоранияЗакись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
См. подробнее: Системы закиси азота. В пищевой промышленностиВ пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ. ХранениеХранение: при комнатной температуре в закрытом помещении, вдали от огня. Ссылки
Wikimedia Foundation. 2010. Нужно решить контрольную?
Полезное | |
Оксид азота(I), химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Закись азота – структура, свойства, использование и эффекты
Закись азота представляет собой неорганическую молекулу, состоящую из двух элементов азота и одного элемента кислорода. Закись азота является одним из переменных оксидов, связанных с азотом. Однако он не относится к газам NOₓ, ответственным за загрязнение воздуха. Этот газ был первоначально обнаружен химиком по имени Джозеф Пристли.
Химическое название и формула закиси азота
Химическое название закиси азота называется окисью азота (I) или закисью азота. Химическая формула закиси азота: N9.0007 2 O и эта формула представляет собой один атом кислорода и два атома азота. Это нереакционноспособный газ, а степень окисления азота в закиси азота равна +1.
Структура закиси азота
Закись азота представляет собой линейную неорганическую молекулу. Пи-связь, присутствующая внутри молекулы, проявляет резонанс. Комплексная структура закиси азота демонстрирует длину связи, состоящую из 119 пикометров связей N-O и 113 пикометров связей N-N.
Комплексная структура закиси азота демонстрирует длину связи, состоящую из 119 пикометров связей N-O и 113 пикометров связей N-N.
Свойства закиси азота
Физические свойства закиси азота следующие.
Закись азота существует в газообразном состоянии.
По своей природе бесцветен.
Имеет нейтральную молекулу.
Имеет сладкий вкус и приятный запах.
Молекулярная масса закиси азота составляет 44 г/моль.
Хорошо растворим в воде.
Закись азота негорючая по своей природе, и ее пары значительно плотнее воздуха.

Химические свойства закиси азота следующие.
Закись азота является одним из газов, вызывающих глобальное потепление.
Закись азота бурно разлагается при воздействии высоких температур.
Закись азота в небольших количествах действует как анестетик, используемый при небольших хирургических вмешательствах.
Разлагается на кислород и азот при 873 К. Поэтому поддерживает реакцию горения в присутствии источника кислорода.
Степень окисления азота +1 в закиси азота.
Использование закиси азота
Закись азота используется в качестве ветеринарного и человеческого анестезирующего вещества.

Закись азота используется для производства химикатов, используемых в ракетном топливе.
Также используется в качестве пенообразователя.
Используется в качестве окислителя, а также в стоматологии.
Закись азота используется в хирургии в качестве анестезирующего средства, а также в качестве средства от аэрозолей.
Воздействие закиси азота
Закись азота вызывает умственные расстройства и мутации, повреждая ДНК.
Он также вызывает кислородное голодание, а хроническое воздействие закиси азота приводит к дефициту витамина B₁₂.

Закись азота оказывает анксиолитическое действие.
Также проявляет эйфорический эффект.
Чтобы узнать больше об этом газе и укрепить свои концептуальные основы, войдите в Веданту и найдите лучший учебный материал. Узнайте, что говорят эксперты об этом газе. Найдите более глубокую и концептуальную информацию и соответствующим образом подготовьте свои заметки к экзаменам.
Получение закиси азота
Закись азота получают реакцией нагревания. Нитрат аммония нагревается при высокой температуре, и в качестве продукта образуется закись азота, а в качестве побочного продукта — молекула воды. Нитрат аммония представляет собой термически нестабильную молекулу. Поэтому он разлагается при высоких температурах.
\[NH_{4}NO_{3} \rightarrow N_{2}O + 2H_{2}O\]
Азот соединяется с кислородом при различных условиях с образованием ряда бинарных оксидов, различающихся по степени окисления атома азота. Они варьируются от закиси азота (степень окисления азота +1) до оксида азота (степень окисления азота +2), триоксида азота (степень окисления азота +3), тетраоксида азота (степень окисления азота +4). до пентаоксида азота (степень окисления азота +5). Формула оксида азота представляет собой количество атомов азота и атомов кислорода в молекуле.
Они варьируются от закиси азота (степень окисления азота +1) до оксида азота (степень окисления азота +2), триоксида азота (степень окисления азота +3), тетраоксида азота (степень окисления азота +4). до пентаоксида азота (степень окисления азота +5). Формула оксида азота представляет собой количество атомов азота и атомов кислорода в молекуле.
Nitrogen Oxide Formula
Nitrogen Oxide Formula | Oxidation State of Nitrogen | Physical Appearance, Acidic or Neutral Character | Properties | |||
Монооксид азота (N 2 O) | +1 | Бесцветный газ и нейтральный | Unreactive gas | |||
Nitric oxide (NO) | +2 | Colourless gas and neutral | Paramagnetic, reactive and thermodynamically unstable | |||
Dinitrogen trioxide ( N 2 O 3 ) | +3 | Бледно-голубое твердое и кислое | Неустойчиво в газовой фазе | |||
Dinitrogen Tetraoxide (N 2 O 4 ) | +4 | . и жидкая фаза и жидкая фаза | ||||
Диоксид азота (№ 2 ) | +4 | Brown Gasic | Paramic | DEATICIV0003 | ||
Dinitrogen Pentaoxide | +5 | Бесрасносят или газ и кислый | Установленные как газовые, в сплошных турнирах. ) — |
Закись азота — Энциклопедия Нового Света
| Закись азота | ||
|---|---|---|
| ||
| Общие | ||
| Молекулярная формула | Н 2 О | |
| Молярная масса | 44,0128 г/моль | |
| Внешний вид | бесцветный газ | |
| CAS-номер | 10024-97-2 | |
| Недвижимость | ||
| Плотность и фаза | 1222,8 кг·м -3 (жидкость) | |
| Растворимость в воде | ||
| Температура плавления | -90,86 ° С (182,29 К) | |
| Точка кипения | -88,48 ° С (184,67 К) | |
| Структура | ||
| Молекулярная форма | линейный | |
| Дипольный момент | 0,166 Д | |
| Термодинамические данные | ||
| Std энтальпия образования Δ f H | +82,05 кДж/моль | |
| Опасности | ||
| Паспорт безопасности | Внешний MSDS | |
| Классификация ЕС | Окислитель ( O ) | |
| NFPA 704 |
| |
| R-фразы | Р8 | |
| S-фразы | С38 | |
| Страница дополнительных данных | ||
| Структура и свойства | n , ε r и т. д. д. | |
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газообразное | |
| Спектральные данные | УФ, ИК, ЯМР, МС | |
| Родственные соединения | ||
| Родственные оксиды азота | Окись азота Азот двуокись Азот триоксид Азот четырехокись Азот пятиокись | |
| Родственные соединения | Азотная кислота Азотистая кислота | |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) | ||
Закись азота , также известная как диазот оксид или диазот моноксид , представляет собой химическое соединение с формулой N 2 O.7 [1] это бесцветный негорючий газ с приятным, слегка сладковатым запахом. Он широко известен как веселящий газ из-за эйфорического эффекта от его вдыхания. В атмосфере он действует как мощный парниковый газ.
В атмосфере он действует как мощный парниковый газ.
Содержание
- 1 История
- 2 Химия
- 3 Производство
- 4 варианта использования
- 4.1 Воздействие при вдыхании
- 4.1.1 Медицинское или стоматологическое применение
- 4.1.2 Рекреационное использование
- 4.2 Аэрозольный пропеллент
- 4.3 Ракетные двигатели
- 4.4 Двигатель внутреннего сгорания
- 4.1 Воздействие при вдыхании
- 5 Безопасность
- 6 Закись азота в атмосфере
- 7 Примечания
- 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
Благодаря своим свойствам это химическое вещество имеет множество применений. Например, он используется в хирургии и стоматологии из-за его анестезирующего и обезболивающего действия. Это аэрозольный распылитель в кулинарных спреях и баллончиках со взбитыми сливками. Он может служить окислителем в ракетных двигателях и может значительно увеличить мощность автомобильных двигателей внутреннего сгорания, так как газ вводится во впускной тракт.
История
Газ был впервые синтезирован в 1793 году английским химиком и священником Джозефом Пристли, который назвал его флогистированным азотистым воздухом. [2] Он описал приготовление «азотистого воздуха с пониженным содержанием азота» путем нагревания железных опилок, смоченных азотной кислотой, в «Эксперименты и наблюдения на различных видах воздуха» (1775). Пристли был в восторге от своего открытия: «Теперь я обнаружил воздух в пять или шесть раз лучше обычного… ничто из того, что я когда-либо делал, не удивляло меня больше и не удовлетворяло меня больше». [3]
В 1790-х годах Хамфри Дэви испытал газ на себе и некоторых своих друзьях, включая поэтов Сэмюэля Тейлора Кольриджа и Роберта Саути. Вскоре они поняли, что закись азота значительно притупляла болевые ощущения, даже если ингалятор все еще находился в полубессознательном состоянии. Позже он стал использоваться в качестве анестетика, особенно стоматологами, которые обычно не имеют доступа к услугам анестезиолога и могут получить пользу от пациента, который может реагировать на словесные команды.
Химия
Молекула закиси азота (N 2 O) представляет собой линейную цепь из трех атомов: атом азота, связанный со вторым атомом азота, который, в свою очередь, связан с атомом кислорода. Структуру можно представить как резонансный гибрид N=N + -O — и — N=N + = O .
Закись азота изоэлектронна с двуокисью углерода. Его можно приготовить путем нагревания аммиачной селитры в лаборатории. Его можно использовать для получения нитритов путем смешивания с кипящими щелочными металлами или для окисления органических соединений при высоких температурах.
Производство
Закись азота обычно получают путем нагревания нитрата аммония. Этот метод был разработан французским химиком Клодом Луи Бертолле в 1785 году и с тех пор широко используется. К сожалению, этот метод сопряжен с потенциальным риском взрыва из-за перегрева нитрата аммония.
- NH 4 NO 3 (AQ) → N 2 O (G) + 2H 2 O (L) (ΔH = -36,8 KJ) 9068 (L) (ΔH = -36,8 KJ)
 0630
0630
Добавление различных фосфатов способствует образованию более чистого газа. Эта реакция происходит при температуре от 170 до 240 °C, при которой нитрат аммония является умеренно чувствительным взрывчатым веществом и очень сильным окислителем (возможно, порядка дымящей азотной кислоты). При температурах намного выше 240 °C экзотермическая реакция может протекать, возможно, вплоть до детонации. Смесь необходимо охладить, чтобы избежать такой беды. На практике реакция включает в себя ряд утомительных регулировок для поддержания температуры в узком диапазоне, в котором она не может оставаться естественным образом. Профессионалы разрушили целые кварталы, потеряв контроль над такими коммерческими процессами. Примеры включают фиаско в Огайо Кемикал в Монреале в 1919 г.66, и катастрофа Air Products & Chemicals в Делавэр-Сити, штат Делавэр, в 1977 году.
Прямое окисление аммиака может когда-нибудь конкурировать с пиролизным синтезом нитрата аммония закиси азота, упомянутым выше. В этом капиталоемком процессе, зародившемся в Японии, используется катализатор на основе диоксида марганца и оксида висмута. (Сува и др., 1961; Showa Denka Ltd.)
В этом капиталоемком процессе, зародившемся в Японии, используется катализатор на основе диоксида марганца и оксида висмута. (Сува и др., 1961; Showa Denka Ltd.)
- 2NH 3 + 2O 2 → N 2 O + 3H 2 O
Высшие оксиды азота образуются в виде примесей. Обратите внимание, что некаталитическое окисление аммиака (т. е. горение или взрыв) происходит в основном до N 2 и H 2 O. В процессе Оствальда аммиак окисляется до оксида азота (NO) с использованием платины; это начало современного синтеза азотной кислоты из аммиака.
Закись азота можно получить путем нагревания раствора сульфаминовой и азотной кислот. Таким образом в Болгарии производилось много газа (Брозаджиев и Реттос, 1975).
- HNO 3 + NH 2 SO 3 H → N 2 O + H 2 SO 4 + H 2 O
В этой реакции нет опасности взрыва, если скорость смешивания контролируется. Однако, как обычно, образуются и токсичные высшие оксиды азота.
Однако, как обычно, образуются и токсичные высшие оксиды азота.
Бесцветные растворы гидрохлорида гидроксиламина и нитрита натрия также могут быть использованы для получения N 2 O.
- (NH 3 OH+Cl-) + NaNO 2 → N 2 O + NaCl + H 2 O
достаточно для вдыхания, а единственным оставшимся побочным продуктом является соленая вода. Однако если к раствору нитрита добавить раствор гидроксиламина (нитрит в избытке), то образуются токсичные высшие оксиды азотной формы.
Применение
Вдыхание
8-граммовая канистра с закисью азота.
Закись азота (N 2 O) является диссоциативным препаратом, который при вдыхании может вызывать анальгезию, эйфорию, головокружение, искажение звука и легкие галлюцинации.
Применение в медицине или стоматологии
В 1800-х годах стоматологи и хирурги использовали закись азота из-за ее мягких обезболивающих свойств. Сегодня закись азота используется в стоматологических процедурах для обеспечения ингаляционной седации и снижения беспокойства пациентов. В малых дозах в медицинских или стоматологических учреждениях закись азота очень безопасна, поскольку закись азота смешивается с достаточным количеством кислорода с помощью регулирующего клапана. Однако длительное, интенсивное использование вдыхаемой закиси азота было связано с поражениями Олни.
Сегодня закись азота используется в стоматологических процедурах для обеспечения ингаляционной седации и снижения беспокойства пациентов. В малых дозах в медицинских или стоматологических учреждениях закись азота очень безопасна, поскольку закись азота смешивается с достаточным количеством кислорода с помощью регулирующего клапана. Однако длительное, интенсивное использование вдыхаемой закиси азота было связано с поражениями Олни.
Использование в рекреационных целях
С момента самого раннего использования закиси азота в медицинских или стоматологических целях она также использовалась в рекреационных целях, поскольку вызывает эйфорию, легкие галлюцинации и, в некоторых случаях, потенциальные эффекты афродизиака. Только небольшое количество рекреационных пользователей (например, работники стоматологических кабинетов или медицинские техники по газу) имеют законный доступ к канистрам с чистой закисью азота, которые предназначены для медицинского или стоматологического использования. Большинство рекреационных пользователей получают закись азота из баллонов со сжатым газом, в которых закись азота используется в качестве топлива для взбитых сливок, из небольших канистр с закисью азота, предназначенных для использования с дозаторами взбитых сливок, или из автомобильных систем закиси азота. Автомобильная закись азота, доступная для населения, содержит следовые количества соединений серы, добавленных для предотвращения использования в рекреационных целях. Добавки серы только придают газу неприятный вкус и запах, никоим образом не уменьшая его действие.
Большинство рекреационных пользователей получают закись азота из баллонов со сжатым газом, в которых закись азота используется в качестве топлива для взбитых сливок, из небольших канистр с закисью азота, предназначенных для использования с дозаторами взбитых сливок, или из автомобильных систем закиси азота. Автомобильная закись азота, доступная для населения, содержит следовые количества соединений серы, добавленных для предотвращения использования в рекреационных целях. Добавки серы только придают газу неприятный вкус и запах, никоим образом не уменьшая его действие.
Пользователи обычно надувают воздушный шар или пластиковый пакет закисью азота и вдыхают газ для получения эффекта. При вдыхании закиси азота пользователи сталкиваются с риском травм или смерти от кислородного голодания. Закись азота, вдыхаемая непосредственно из металлической канистры или резервуара, или при использовании самодельной маски на рот, непосредственно соединенной с канистрой или резервуаром, оказывает значительно более опасное воздействие.
Аэрозольный пропеллент
Газ одобрен для использования в качестве пищевой добавки (также известен как E942), в частности, в качестве пропеллента для аэрозольных распылителей. Его наиболее распространенное использование в этом контексте — в аэрозольных баллончиках со взбитыми сливками, кулинарных спреях и в качестве инертного газа, используемого для вытеснения кислорода, вызывающего затхлость, при заполнении упаковок картофельных чипсов и других подобных закусок.
Газ хорошо растворяется в жирных соединениях. В аэрозольных взбитых сливках он растворяется в жирных сливках до тех пор, пока не покинет банку, когда он становится газообразным и, таким образом, образует пену. При таком использовании он производит взбитые сливки, в четыре раза превышающие объем жидкости, тогда как взбивание воздуха в сливки дает только вдвое больший объем. Если бы в качестве пропеллента использовался воздух, кислород при повышенном давлении ускорил бы прогоркание молочного жира, а закись азота препятствует такому разложению. Однако взбитые сливки, приготовленные с использованием закиси азота, нестабильны и возвращаются в более или менее жидкое состояние в течение от получаса до одного часа. Таким образом, метод не подходит для украшения блюд, которые не будут подаваться сразу.
Однако взбитые сливки, приготовленные с использованием закиси азота, нестабильны и возвращаются в более или менее жидкое состояние в течение от получаса до одного часа. Таким образом, метод не подходит для украшения блюд, которые не будут подаваться сразу.
Аналогичным образом, кулинарный спрей, изготовленный из различных типов масел в сочетании с лецитином (эмульгатором), может использовать закись азота в качестве пропеллента. Другие пропелленты, используемые в кулинарных спреях, включают пищевой спирт и пропан.
Ракетные двигатели
Закись азота может использоваться в качестве окислителя в ракетных двигателях. Его преимущества перед другими окислителями заключаются в том, что он нетоксичен, а благодаря стабильности при комнатной температуре его легко хранить и относительно безопасно перевозить в полете.
Закись азота была предпочтительным окислителем в нескольких конструкциях гибридных ракет (использующих твердое топливо с жидким или газообразным окислителем). Комбинация закиси азота с полибутадиеновым топливом с концевыми гидроксильными группами использовалась SpaceShipOne и другими. Он также широко используется в любительской и ракетной технике большой мощности с различными пластиками в качестве топлива. В эпизоде MythBusters была показана гибридная ракета, построенная с использованием смеси парафина и порошкообразного углерода (а позже и салями) в качестве твердого топлива и закиси азота в качестве окислителя.
Комбинация закиси азота с полибутадиеновым топливом с концевыми гидроксильными группами использовалась SpaceShipOne и другими. Он также широко используется в любительской и ракетной технике большой мощности с различными пластиками в качестве топлива. В эпизоде MythBusters была показана гибридная ракета, построенная с использованием смеси парафина и порошкообразного углерода (а позже и салями) в качестве твердого топлива и закиси азота в качестве окислителя.
Закись азота также может использоваться в монотопливных ракетах. В присутствии нагретого катализатора N 2 O будет экзотермически разлагаться на азот и кислород при температуре приблизительно 1300°С. В вакуумном двигателе это может обеспечить удельный импульс монотоплива ( I sp ) до 180 с. Хотя он заметно меньше, чем I sp , доступный для гидразиновых двигателей (однотопливных или двухкомпонентных с тетраоксидом азота), пониженная токсичность делает закись азота заслуживающей внимания.
Двигатель внутреннего сгорания
В автомобильных гонках закись азота (часто называемая в этом контексте просто «закись азота», чтобы отличить ее от аббревиатуры NOS, используемой для торговой марки Nitrous Oxide Systems) иногда впрыскивается во впускной коллектор (или перед впускным коллектором; некоторые системы впрыскивают непосредственно перед цилиндром) для увеличения мощности. Сам по себе газ негорюч, но он выделяет больше кислорода, чем атмосферный воздух, разлагаясь при повышенных температурах, что позволяет двигателю сжигать больше топлива и воздуха, что приводит к более мощному сгоранию. Закись азота хранится в виде сжатой жидкости, испарение и расширение жидкой закиси азота во впускном коллекторе вызывает значительное падение температуры наддува на впуске, что приводит к более плотному наддуву, что дополнительно позволяет большему количеству воздушно-топливной смеси поступать в цилиндр. Более низкая температура также может уменьшить детонацию.
Та же техника использовалась во время Второй мировой войны самолетами Люфтваффе с системой GM 1 для увеличения выходной мощности авиационных двигателей. Первоначально предназначенный для обеспечения стандартных самолетов Люфтваффе превосходными высотными характеристиками, технологические соображения ограничивали его использование чрезвычайно большими высотами. Соответственно, он применялся только в специализированных самолетах, таких как высотные разведчики, скоростные бомбардировщики и высотные перехватчики.
Первоначально предназначенный для обеспечения стандартных самолетов Люфтваффе превосходными высотными характеристиками, технологические соображения ограничивали его использование чрезвычайно большими высотами. Соответственно, он применялся только в специализированных самолетах, таких как высотные разведчики, скоростные бомбардировщики и высотные перехватчики.
Одна из основных проблем использования закиси азота в поршневых двигателях заключается в том, что она может производить мощность, достаточную для повреждения или разрушения двигателя. Возможно увеличение мощности на 25–300 процентов, и если механическая конструкция двигателя не будет должным образом усилена, двигатель может быть серьезно поврежден или разрушен во время такой операции.
При закиси азота в двигателях внутреннего сгорания очень важно поддерживать надлежащие рабочие температуры и уровни топлива, чтобы предотвратить преждевременное зажигание , или детонацию (иногда называемую детонацией или звоном ).
Безопасность
Сжатая закись азота хранится при отрицательных температурах. Утечка или неожиданный выброс сжатой закиси азота может привести к немедленному обморожению. Кроме того, хотя он обычно инертен при хранении и довольно безопасен в обращении, он может энергично разлагаться и потенциально детонировать, если его инициировать при неправильных обстоятельствах.
Жидкая закись азота действует как хороший растворитель для многих органических соединений, но жидкие смеси могут образовывать несколько чувствительных взрывчатых веществ. Загрязнение топливом было связано с несколькими авариями ракетных установок, когда детонировали небольшие количества закиси азота / топливных смесей, вызывая взрывное разложение остаточного закиси азота в водопроводе.
В биологических системах закись азота инактивирует кобаламиновую форму витамина B 12 путем окисления. Симптомы витамина В 12 Дефицит, включая сенсорную невропатию, миелопатию и энцефалопатию, может возникнуть в течение нескольких дней или недель после анестезии закисью азота у людей с субклиническим дефицитом витамина B 12 . Симптомы лечат высокими дозами витамина B 12 , но выздоровление может быть медленным и неполным. Люди с нормальным уровнем витамина B 12 имеют достаточные запасы витамина B 12 , чтобы сделать воздействие закиси азота незначительным, если воздействие не повторяется и не увеличивается (злоупотребление закисью азота). Витамин В 12 уровни должны быть проверены у людей с факторами риска дефицита витамина B 12 перед применением анестезии закисью азота.
Симптомы лечат высокими дозами витамина B 12 , но выздоровление может быть медленным и неполным. Люди с нормальным уровнем витамина B 12 имеют достаточные запасы витамина B 12 , чтобы сделать воздействие закиси азота незначительным, если воздействие не повторяется и не увеличивается (злоупотребление закисью азота). Витамин В 12 уровни должны быть проверены у людей с факторами риска дефицита витамина B 12 перед применением анестезии закисью азота.
Закись азота в атмосфере
Тенденции выбросов парниковых газов.
В отличие от других оксидов азота, закись азота является мощным парниковым газом; на единицу веса, его влияние на глобальное потепление в 296 раз больше, чем у углекислого газа (CO 2 ). [4] Таким образом, закись азота является частью усилий (таких как Киотский протокол) по ограничению выбросов парниковых газов. (Другие оксиды азота косвенно влияют на глобальное потепление, способствуя образованию тропосферного озона во время образования смога).
(Другие оксиды азота косвенно влияют на глобальное потепление, способствуя образованию тропосферного озона во время образования смога).
Закись азота также воздействует на озон в стратосфере, усугубляя избыточное количество УФ-излучения, падающего на поверхность Земли в последние десятилетия (различные фреоны и родственные им галогенированные органические вещества также потребляют озон в стратосфере). Закись азота является основным природным регулятором стратосферного озона.
Закись азота естественно выделяется бактериями в почве и океанах. Сельское хозяйство является основным источником закиси азота, производимой человеком: обработка почвы, использование азотных удобрений и обращение с отходами животноводства могут стимулировать естественные бактерии к производству большего количества закиси азота. Сектор животноводства (в основном коровы, куры и свиньи) производит 65 процентов закиси азота, связанной с человеком. [5] Промышленные источники составляют лишь около 20 процентов всех антропогенных источников и включают производство нейлона и азотной кислоты, а также сжигание ископаемого топлива в двигателях внутреннего сгорания.
Считается, что деятельность человека составляет несколько менее 2 тераграммов оксидов азота в год; природа, более 15 тераграмм. [6] Глобальный антропогенный поток закиси азота составляет около 1 петаграмма углеродного эквивалента диоксида углерода в год; это сопоставимо с 2 петаграммами углеродных эквивалентов метана и диоксида углерода в год и со скоростью загрузки атмосферы примерно 3,3 петаграммами углеродных эквивалентов диоксида углерода в год.
Примечания
- ↑ Закись азота, N 2 O, не следует путать с другими оксидами азота, такими как оксид азота NO и двуокись азота NO 2 .
- ↑ Закись азота — веселящий газ. Школа химии Бристольского университета. Проверено 31 мая 2007 г.
- ↑ Дж. Р. Партингтон, Краткая история химии, 3-е изд. (Нью-Йорк: Dover Publications, 1989), 110–121.
- ↑ Изменение климата 2001: Рабочая группа 1: Научная основа. Межправительственная группа экспертов по изменению климата.
 Проверено 31 мая 2007 г.
Проверено 31 мая 2007 г. - ↑ Длинная тень домашнего скота: экологические проблемы и варианты. vitalcentre.org . Проверено 31 мая 2007 г.
- ↑ Закись азота: источники и выбросы. Агентство по охране окружающей среды США . Проверено 31 мая 2007 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Чанг, Рэймонд. 2006. Химия, 9-е изд. Нью-Йорк: McGraw-Hill Science/Engineering/Math. ISBN 0073221031.
- Коттон, Ф. Альберт, Джеффри Уилкинсон, Карлос А. Мурильо и Манфред Бохманн. 1999. Передовая неорганическая химия 6-е изд. Нью-Йорк: Уайли. ISBN 0471199575.
- Эгер, Эдмонд И. 1985. Закись азота N 2 O . Амстердам: Elsevier Science. ISBN 0444008608 .
- Лэнгфилд, Тревор. 2006. Как построить и настроить системы закиси азота. Дорчестер, Великобритания: Veloce. ISBN 18890.
- Шелдин, Майкл, Дэвид Валлечински и Сони Сальер.
 1993. Веселящий газ: закись азота, 2-е изд. Беркли, Калифорния: паб Ronin. ISBN 0
1993. Веселящий газ: закись азота, 2-е изд. Беркли, Калифорния: паб Ronin. ISBN 01526.
Внешние ссылки
Все ссылки получены 6 декабря 2018 г.
- Пол Дж. Крутцен: Химия атмосферы. Научный фонд Вега . (Видео интервью Пола Крутцена Гарри Крото в свободном доступе.)
- Закись азота. Подземелья Эровида .
| E номера | ||
|---|---|---|
| Красители (E100-199) • Консерванты (E200-299) • Антиоксиданты и регуляторы кислотности (E300-399) • Загустители, стабилизаторы и эмульгаторы (E400-499) • Регуляторы pH и агенты, предотвращающие слеживание (E500-599) ) • Усилители вкуса (E600-699) • Разное (E900-999) • Дополнительные химические вещества (E1100-1599) | ||
| Воски (E900-909) • Синтетические глазури (E910-919) • Улучшители (E920-929) • Упаковочные газы (E930-949) • Подсластители (E950-969) • Пенообразователи (E990-999) | ||
| Аргон (E938) • Гелий (E939) • Дихлордифторметан (E940) • Азот (E941) • Закись азота (E942) • Бутан (E943a) • E4 Пропан (E9) • Изобутан (E9) • Изобутан Кислород (E948) • Водород (E949) | ||
| Общие анестетики (N01A) | |
|---|---|
| Барбитураты | Гексобарбитал, Метогекситал, Наркобарбитал, Тиопентал |
| Эфиры | Диэтиловый эфир, десфлуран, энфлуран, изофлуран, метоксифлуран, метоксипропан, севофлуран, виниловый эфир |
| Галогеналканы | Хлороформ, Галотан, Трихлорэтилен |
| Опиоиды | Алфентанил, анилеридин, фентанил, феноперидин, ремифентанил, суфентанил |
| Другие | Альфаксалон, Дроперидол, Эскетамин, Этомидат, Гидроксимасляная кислота, Кетамин, Минаксолон, Закись азота, Пропанидид, Пропофол, Ксенон |
Авторы
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью в Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Закись азота история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Закиси азота»
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Refraction — New World Encyclopedia
Соломинка, смоченная в цветном растворе, кажется сломанной из-за преломления света при переходе из раствора в воздух.
Преломление — это изменение направления волны вследствие изменения ее скорости, наблюдаемое при переходе волны из одной среды в другую. Наиболее распространенным примером является преломление света, как это происходит при образовании радуги на небе или радужных полос, когда белый свет проходит через стеклянную призму. Преломлению подвергаются и другие типы волн, например, при переходе звуковых волн из одной среды в другую.
Преломление волн в среде количественно определяется так называемым показатель преломления (или показатель преломления ). Показатель преломления среды — это мера того, насколько скорость света (или других волн) уменьшается внутри среды по сравнению со скоростью света в вакууме или воздухе. Например, если образец стекла имеет показатель преломления 1,5, это означает, что скорость света, проходящего через стекло, в 1/1,5 = 0,67 {\ displaystyle 1/1,5 = 0,67} умножается на скорость света в вакууме или воздухе. .
Содержимое
- 1 Пояснение
- 2 Показатель преломления
- 2.
 1 Скорость света
1 Скорость света - 2.2 Отрицательный показатель преломления
- 2.
- 3 Список показателей преломления
- 4 Рассеивание и абсорбция
- 5 Двулучепреломление
- 6 Нелинейность
- 7 Неоднородность
- 8 приложений
- 9 Альтернативное значение: Рефракция в металлургии
- 10 См. также
- 11 Каталожные номера
- 12 Внешние ссылки
- 13 кредитов
На основе знаний о свойствах преломления и показателя преломления был разработан ряд приложений. Например, изобретение линз и телескопов-рефракторов основано на понимании преломления. Также знание показателя преломления различных веществ используется для оценки чистоты вещества или измерения его концентрации в смеси. В тестах зрения, проводимых офтальмологами или оптометристами, свойство рефракции лежит в основе техники, известной как рефрактометрия.
Объяснение
В оптике преломление происходит, когда световые волны распространяются из среды с определенным показателем преломления во вторую среду с другим показателем преломления. На границе сред фазовая скорость волны изменяется, она меняет направление, длина волны увеличивается или уменьшается, но частота остается постоянной. Например, световой луч будет преломляться, когда он входит и выходит из стекла. Понимание этой концепции привело к изобретению линз и телескопа-рефрактора.
На границе сред фазовая скорость волны изменяется, она меняет направление, длина волны увеличивается или уменьшается, но частота остается постоянной. Например, световой луч будет преломляться, когда он входит и выходит из стекла. Понимание этой концепции привело к изобретению линз и телескопа-рефрактора.
Преломление световых волн в воде. Темный прямоугольник представляет фактическое положение карандаша в миске с водой. Светлый прямоугольник представляет видимое положение карандаша. Обратите внимание, что конец (X) выглядит так, как будто он находится в (Y), положение, которое значительно меньше, чем (X).
Преломление можно увидеть, глядя в чашу с водой. Воздух имеет показатель преломления около 1,0003, а вода имеет показатель преломления около 1,33. Если человек смотрит на прямой предмет, например, на карандаш или соломинку, который находится под наклоном частично в воде, кажется, что этот предмет изгибается у поверхности воды. Это происходит из-за искривления световых лучей при переходе из воды в воздух. Как только лучи достигают глаза, глаз прослеживает их обратно в виде прямых линий (линий взгляда). Линии обзора (показанные пунктирными линиями) пересекаются в более высоком положении, чем место, где исходят фактические лучи. Это приводит к тому, что карандаш кажется выше, а вода кажется более мелкой, чем она есть на самом деле. Глубина, которой кажется вода, если смотреть сверху, известна как 9.0395 кажущаяся глубина,
Как только лучи достигают глаза, глаз прослеживает их обратно в виде прямых линий (линий взгляда). Линии обзора (показанные пунктирными линиями) пересекаются в более высоком положении, чем место, где исходят фактические лучи. Это приводит к тому, что карандаш кажется выше, а вода кажется более мелкой, чем она есть на самом деле. Глубина, которой кажется вода, если смотреть сверху, известна как 9.0395 кажущаяся глубина,
Схема преломления волн на воде
Диаграмма справа показывает пример преломления волн на воде. Рябь движется слева и проходит по более мелкой области, наклоненной под углом к фронту волны. Волны распространяются медленнее на мелководье, поэтому длина волны уменьшается, и волна изгибается на границе. Пунктирная линия представляет нормаль к границе. Пунктирная линия представляет исходное направление волн. Это явление объясняет, почему волны на береговой линии никогда не ударяются о береговую линию под углом. В каком бы направлении ни двигались волны в глубокой воде, они всегда преломляются к нормали, когда входят в более мелкую воду возле пляжа.
Преломление также отвечает за радугу и за расщепление белого света на радужный спектр при прохождении через стеклянную призму. Стекло имеет более высокий показатель преломления, чем воздух, и разные частоты света распространяются с разной скоростью (рассеивание), в результате чего они преломляются под разными углами, так что вы можете их видеть. Разные частоты соответствуют разным наблюдаемым цветам.
В то время как преломление позволяет создавать красивые явления, такие как радуга, оно также может создавать необычные оптические явления, такие как миражи и фата-моргана. Это связано с изменением показателя преломления воздуха в зависимости от температуры.
Преломление в плексигласовом (акриловом) блоке.
Закон Снелла используется для расчета степени преломления света при переходе из одной среды в другую.
Недавно были созданы метаматериалы с отрицательным показателем преломления.
С метаматериалами мы также можем получить явления полного преломления, когда волновые сопротивления двух сред совпадают. Отраженной волны нет.
Отраженной волны нет.
Кроме того, поскольку рефракция может заставить объекты казаться ближе, чем они есть на самом деле, она позволяет воде увеличивать объекты. Во-первых, когда свет входит в каплю воды, он замедляется. Если поверхность воды не плоская, то свет изгибается в новый путь. Эта круглая форма изгибает свет наружу, и по мере его распространения изображение, которое вы видите, становится больше.
Показатель преломления
Показатель преломления (или показатель преломления ) среды является обратным отношением фазовой скорости (определенной ниже) волнового явления, такого как свет или звук, и фазовой скорости в эталонная среда (вещество, через которое проходит волна). Чаще всего он используется в контексте света с вакуумом в качестве эталонной среды, хотя исторически были распространены другие эталонные среды (например, воздух при стандартном давлении и температуре). Обычно ему присваивается символ n, В случае света он равен
- n=ϵr до н.
 э. ;r {\displaystyle n={\sqrt {\epsilon _{r}\mu _{r}}}},
э. ;r {\displaystyle n={\sqrt {\epsilon _{r}\mu _{r}}}},
, где ε r — относительная диэлектрическая проницаемость материала (как материал влияет на электрическую поле), а μ r — его относительная магнитная проницаемость (как материал реагирует на магнитное поле). Для большинства материалов μ r очень близко к 1 на оптических частотах, поэтому n приблизительно равно ϵr{\displaystyle {\sqrt {\epsilon _{r}}}}. n может быть меньше 1, и это имеет практические технические применения, такие как эффективные зеркала для рентгеновских лучей на основе полного внутреннего отражения.
Фазовая скорость определяется как скорость, с которой любая часть сигнала перемещается в пространстве; то есть скорость, с которой движется фаза сигнала. Групповая скорость — это скорость распространения огибающей формы волны ; то есть скорость изменения амплитуды (максимальное движение вверх и вниз) формы волны. Именно групповая скорость, скорость, с которой гребни и впадины волны движутся в пространстве, (почти всегда) представляет собой скорость, с которой информация (и энергия) может передаваться волной, — например, скорость, с которой импульс света распространяется по оптическому волокну.
Именно групповая скорость, скорость, с которой гребни и впадины волны движутся в пространстве, (почти всегда) представляет собой скорость, с которой информация (и энергия) может передаваться волной, — например, скорость, с которой импульс света распространяется по оптическому волокну.
Скорость света
Преломление света на границе раздела двух сред с разными показателями преломления, при n 2 > n 1 . Во второй среде скорость меньше (v 2 < v 1 ), поэтому угол преломления θ 2 меньше угла падения θ 1 ; то есть луч в среде с более высоким индексом ближе к нормали.
Скорость всех электромагнитных излучений в вакууме одинакова, примерно 3×10 8 метров в секунду и обозначается как c . Следовательно, если v — фазовая скорость излучения определенной частоты в конкретном материале, показатель преломления определяется выражением
- n = cv {\ displaystyle n = {\ frac {c} {v}}}.

Это число обычно больше единицы: чем выше индекс материала, тем сильнее замедляется свет. Однако на определенных частотах (например, рентгеновские лучи) n на самом деле будет меньше единицы. Это не противоречит теории относительности, согласно которой ни один несущий информацию сигнал не может распространяться быстрее, чем c, , потому что фазовая скорость не совпадает с групповой скоростью или скоростью сигнала, такой же, как групповая скорость, за исключением случаев, когда волна проходит через поглощающую среду.
Иногда определяют «показатель преломления групповой скорости», обычно называемый групповым показателем :
- ng = cvg {\ displaystyle n_ {g} = {\ frac {c} {v_ {g}}}}
, где v g — групповая скорость. Это значение не следует путать с n, , которая всегда определяется относительно фазовой скорости.
На микроуровне фазовая скорость электромагнитной волны замедляется в материале, потому что электрическое поле создает возмущение в зарядах каждого атома (в первую очередь электронов), пропорциональное (отношение y = kx {\ displaystyle y = kx}) к диэлектрическая проницаемость. Заряды, как правило, колеблются немного не в фазе относительно управляющего электрического поля. Таким образом, заряды излучают собственную электромагнитную волну той же частоты, но с фазовой задержкой. Макроскопическая сумма всех таких вкладов в материале представляет собой волну с той же частотой, но меньшей длиной волны, чем исходная, что приводит к замедлению фазовой скорости волны. Большая часть излучения колеблющихся материальных зарядов модифицирует приходящую волну, изменяя ее скорость. Однако некоторая чистая энергия будет излучаться в других направлениях (см. рассеяние).
Заряды, как правило, колеблются немного не в фазе относительно управляющего электрического поля. Таким образом, заряды излучают собственную электромагнитную волну той же частоты, но с фазовой задержкой. Макроскопическая сумма всех таких вкладов в материале представляет собой волну с той же частотой, но меньшей длиной волны, чем исходная, что приводит к замедлению фазовой скорости волны. Большая часть излучения колеблющихся материальных зарядов модифицирует приходящую волну, изменяя ее скорость. Однако некоторая чистая энергия будет излучаться в других направлениях (см. рассеяние).
Если известны показатели преломления двух материалов для заданной частоты, то по закону Снеллиуса можно вычислить угол, на который будет преломляться излучение этой частоты при переходе от первого материала ко второму.
Отрицательный показатель преломления
Недавние исследования также продемонстрировали существование отрицательного показателя преломления, которое может иметь место, если ε и μ являются одновременно отрицательными. Не считается естественным, это может быть достигнуто с помощью так называемых метаматериалов. Он предлагает возможность создания идеальных линз и других экзотических явлений, таких как обращение закона Снеллиуса.
Не считается естественным, это может быть достигнуто с помощью так называемых метаматериалов. Он предлагает возможность создания идеальных линз и других экзотических явлений, таких как обращение закона Снеллиуса.
Список показателей преломления
| Материал | n при f=5,09×10 14 Гц |
|---|---|
| Вакуум | 1 (точно) |
| Гелий | 1.000036 |
| Воздух @ СТП | 1.0002926 |
| Углекислый газ | 1.00045 |
| Водяной лед | 1.31 |
| Жидкая вода (20°C) | 1,333 |
| Криолит | 1,338 |
| Ацетон | 1,36 |
| Этанол | 1,36 |
| Тефлон | 1,35 — 1,38 |
| Глицерин | 1,4729 |
| Акриловое стекло | 1,490 — 1,492 |
| Каменная соль | 1,516 |
| Кроновое стекло (чистое) | 1,50 — 1,54 |
| Соль (NaCl) | 1,544 |
| Поликарбонат | 1,584 — 1,586 |
| Бесцветное стекло (чистое) | 1,60 — 1,62 |
| Краун (нечистый) | 1,485 — 1,755 |
| Бром | 1,661 |
| Бесцветное стекло (нечистое) | 1,523 — 1,925 |
| Цирконий | 2,15 — 2,18 |
| Алмаз | 2,419 |
| Муассанит | 2,65 — 2,69 |
| Киноварь (сульфид ртути) | 3,02 |
| Фосфид галлия(III) | 3,5 |
| Арсенид галлия(III) | 3,927 |
| Кремний | 4. 01 01 |
Многие материалы имеют хорошо охарактеризованные показатели преломления, но эти показатели сильно зависят от частоты света. Поэтому любое числовое значение индекса не имеет смысла, если не указана соответствующая частота.
Существуют также более слабые зависимости от температуры, давления/напряжения и т. д., а также от точного состава материала. Однако для многих материалов и типичных условий эти вариации находятся на уровне процентов или меньше. Поэтому особенно важно указать источник для измерения индекса, если требуется точность.
В общем случае показатель преломления представляет собой комплексное число, имеющее как действительную, так и мнимую часть, где последняя указывает на силу потери поглощения на определенной длине волны, поэтому мнимую часть иногда называют коэффициентом экстинкции к. Такие потери становятся особенно значительными, например, в металлах при коротких длинах волн (таких как видимый свет) и должны быть включены в любое описание показателя преломления.
Дисперсия и поглощение
В реальных материалах поляризация не мгновенно реагирует на приложенное поле. Это вызывает диэлектрические потери, которые могут быть выражены диэлектрической проницаемостью, которая является комплексной и зависит от частоты. Реальные материалы также не являются идеальными изоляторами, а это означает, что они имеют ненулевую проводимость постоянного тока (DC). Принимая во внимание оба аспекта, мы можем определить комплексный показатель преломления:
- n~=n−iκ{\displaystyle {\tilde {n}}=n-i\kappa}
Здесь n — показатель преломления, указывающий фазовую скорость, а κ называется коэффициентом экстинкции. , который указывает величину потерь на поглощение при распространении электромагнитной волны через материал. И n , и κ зависят от частоты.
Эффект изменения n в зависимости от частоты (за исключением вакуума, где все частоты распространяются с одинаковой скоростью c ) известен как дисперсия, и это то, что заставляет призму делить белый свет на составляющие его спектральные цвета, так образуются радуги в дождь или туман. Дисперсия также является причиной хроматических аберраций в объективах.
Дисперсия также является причиной хроматических аберраций в объективах.
Поскольку показатель преломления материала зависит от частоты (и, следовательно, длины волны) света, обычно указывается соответствующая длина волны в вакууме, при которой измеряется показатель преломления. Как правило, это делается на различных четко определенных спектральных линиях излучения; например, n D — показатель преломления на линии Фраунгофера «D», центре желтого двойного излучения натрия при длине волны 589,29 нм.
Уравнение Селлмейера — это эмпирическая формула, которая хорошо подходит для описания дисперсии, а коэффициенты Селлмейера часто указываются в таблицах вместо показателя преломления. Некоторые репрезентативные показатели преломления на разных длинах волн см. в списке показателей преломления.
Как показано выше, диэлектрические потери и ненулевая проводимость по постоянному току в материалах вызывают поглощение. Хорошие диэлектрические материалы, такие как стекло, имеют чрезвычайно низкую проводимость по постоянному току, а на низких частотах диэлектрические потери также незначительны, что приводит к почти полному отсутствию поглощения (κ ≈ 0). Однако на более высоких частотах (таких как видимый свет) диэлектрические потери могут значительно увеличить поглощение, уменьшая прозрачность материала для этих частот.
Однако на более высоких частотах (таких как видимый свет) диэлектрические потери могут значительно увеличить поглощение, уменьшая прозрачность материала для этих частот.
Действительная и мнимая части комплексного показателя преломления связаны соотношением Крамерса-Кронига. Например, можно определить полный комплексный показатель преломления материала как функцию длины волны из спектра поглощения материала.
Двулучепреломление
Кристалл кальцита, лежащий на бумаге, с некоторыми буквами, показывающими двойное лучепреломление.
Показатель преломления некоторых сред может различаться в зависимости от поляризации и направления распространения света в среде. Это известно как двойное лучепреломление и описано в области кристаллооптики.
Нелинейность
Сильное электрическое поле света высокой интенсивности (например, излучение лазера) может вызывать изменение показателя преломления среды при прохождении света, что приводит к нелинейной оптике. Если показатель изменяется квадратично с полем (линейно с интенсивностью), это называется оптическим эффектом Керра и вызывает такие явления, как самофокусировка и фазовая самомодуляция. Если индекс изменяется линейно с полем (что возможно только в материалах, не обладающих инверсионной симметрией), это называется эффектом Поккельса.
Если показатель изменяется квадратично с полем (линейно с интенсивностью), это называется оптическим эффектом Керра и вызывает такие явления, как самофокусировка и фазовая самомодуляция. Если индекс изменяется линейно с полем (что возможно только в материалах, не обладающих инверсионной симметрией), это называется эффектом Поккельса.
Неоднородность
Линза с градиентным показателем преломления с параболическим изменением показателя преломления (n) с радиальным расстоянием (x) . Линза фокусирует свет так же, как и обычная линза.
Если показатель преломления среды не является постоянным, а постепенно изменяется в зависимости от положения, материал называется средой с градиентным показателем преломления и описывается оптикой с градиентным показателем. Свет, проходящий через такую среду, может быть искривлен или сфокусирован, и этот эффект можно использовать для изготовления линз, некоторых оптических волокон и других устройств. Некоторые распространенные миражи вызваны пространственно изменяющимся показателем преломления воздуха.
Некоторые распространенные миражи вызваны пространственно изменяющимся показателем преломления воздуха.
Применение
Показатель преломления материала является наиболее важным свойством любой оптической системы, использующей свойство преломления. Он используется для расчета фокусирующей способности линз и рассеивающей способности призм.
Поскольку показатель преломления является фундаментальным физическим свойством вещества, его часто используют для идентификации конкретного вещества, подтверждения его чистоты или измерения его концентрации. Показатель преломления используется для измерения твердых тел (очки и драгоценные камни), жидкостей и газов. Чаще всего он используется для измерения концентрации растворенного вещества в водном растворе. Рефрактометр — это прибор, используемый для измерения показателя преломления. Для раствора сахара показатель преломления можно использовать для определения содержания сахара.
В медицине, особенно в офтальмологии и оптометрии, метод рефрактометрии использует свойство рефракции для проведения проверки зрения. Это клинический тест, в котором используется фороптер для определения аномалии рефракции глаза и, исходя из этого, назначаются лучшие корректирующие линзы. Представлен ряд тестовых линз с разной оптической силой или фокусным расстоянием, чтобы определить, какие из них обеспечивают наиболее четкое и четкое зрение.
Это клинический тест, в котором используется фороптер для определения аномалии рефракции глаза и, исходя из этого, назначаются лучшие корректирующие линзы. Представлен ряд тестовых линз с разной оптической силой или фокусным расстоянием, чтобы определить, какие из них обеспечивают наиболее четкое и четкое зрение.
Альтернативное значение: Рефракция в металлургии
В металлургии термин преломление имеет другое значение. Это свойство металлов, которое указывает на их способность противостоять нагреву. Металлы с высокой степенью преломления относятся к тугоплавким . Эти металлы имеют высокие температуры плавления из-за сильных межатомных сил, которые участвуют в металлических связях. Для преодоления этих сил требуется большое количество энергии.
Примеры тугоплавких металлов включают молибден, ниобий, вольфрам и тантал. Карбид гафния является наиболее тугоплавким известным бинарным соединением с температурой плавления 3,890 градусов С.[1][2]
См.
 также
также- Двулучепреломление
- Легкий
- Отражение (физика)
- Sound
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Fishbane, Paul M., et al. 2005. Физика для ученых и инженеров, 3-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Education. ISBN 0131418815 .
- Хехт, Джефф. 2006. Дебют Red Light для Exotic ‘Metamaterial’. Служба новостей NewScientist.com . 13:38. Проверено 28 марта 2007 г.
- Хендерсон, Том. 2004. Преломление и лучевая модель света. Кабинет физики . Проверено 20 февраля 2007 г.
- Уорд, Дэвид В., Кейт А. Нельсон и Кевин Дж. Уэбб. 2005. О физическом происхождении отрицательного показателя преломления. Новый журнал физики 7:213. Проверено 28 марта 2007 г.
Внешние ссылки
Все ссылки получены 27 июля 2019 г..
- Преломление через призму. (Моделирование Java.
 )
) - Индекс преломления — Мир физики Эрика Вайсштейна.
- Индекс преломления — Гиперфизика. (Список показателей преломления.)
Авторы
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Преломление история
- Refractive_index история
- List_of_indices_of_refraction история
- Refraction_(металлургия) история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Refraction»
Примечание. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
Диэлектрик — Энциклопедия Нового Света
Различные типы конденсаторов. Каждый конденсатор состоит из пары проводящих пластин, разделенных диэлектриком.
Диэлектрик или электрический изолятор представляет собой материал, обладающий высокой устойчивостью к протеканию электрического тока. Диэлектрические материалы могут быть твердыми, жидкими или газообразными. Кроме того, вакуум является отличным диэлектриком.
Содержание
- 1 Пояснение
- 1.1 Диэлектрическая проницаемость
- 1.2 Диэлектрическая проницаемость
- 2 Диэлектрическая прочность
- 2.1 Напряженность поля пробоя
- 3 Диэлектрики в плоскопараллельных конденсаторах
- 4 Приложения
- 5 Некоторые практичные диэлектрики
- 6 См. также
- 7 Каталожные номера
- 8 Внешние ссылки
- 9 кредитов
Важным применением диэлектриков является разделение обкладок конденсаторов. Способность конденсатора накапливать электрический заряд зависит от диэлектрика, разделяющего его пластины.
Способность конденсатора накапливать электрический заряд зависит от диэлектрика, разделяющего его пластины.
Объяснение
Когда диэлектрическая среда взаимодействует с приложенным электрическим полем, внутри ее атомов или молекул происходит перераспределение зарядов. Это перераспределение меняет форму приложенного электрического поля как внутри диэлектрической среды, так и в близлежащей области.
При движении двух электрических зарядов через диэлектрическую среду энергии взаимодействия и силы между ними уменьшаются. Когда электромагнитная волна проходит через диэлектрик, ее скорость уменьшается, а длина волны укорачивается.
Когда электрическое поле первоначально приложено к диэлектрической среде, протекает ток. Полный ток , протекающий через реальный диэлектрик, состоит из двух частей: тока проводимости и тока смещения. В хороших диэлектриках ток проводимости будет крайне мал. Ток смещения можно рассматривать как упругую реакцию диэлектрического материала на любое изменение приложенного электрического поля. По мере увеличения величины электрического поля протекает ток смещения, и дополнительное смещение накапливается в диэлектрике в виде потенциальной энергии. Когда электрическое поле уменьшается, диэлектрик высвобождает часть накопленной энергии в виде тока смещения. Электрическое смещение можно разделить на вакуумное и диэлектрическое.
По мере увеличения величины электрического поля протекает ток смещения, и дополнительное смещение накапливается в диэлектрике в виде потенциальной энергии. Когда электрическое поле уменьшается, диэлектрик высвобождает часть накопленной энергии в виде тока смещения. Электрическое смещение можно разделить на вакуумное и диэлектрическое.
- D = ε0E + P = ε0E + ε0χE = ε0E (1 + χ), {\ displaystyle \ mathbf {D} = \ varepsilon _ {0} \ mathbf {E} + \ mathbf {P} = \ varepsilon _ {0}\mathbf {E} +\varepsilon _{0}\chi \mathbf {E} =\varepsilon _{0}\mathbf {E} \left(1+\chi \right),}
, где P — поляризация среды, E — электрическое поле, D — плотность электрического потока (или смещение) и его электрическая восприимчивость. Отсюда следует, что относительная диэлектрическая проницаемость и восприимчивость диэлектрика связаны: εr = χ + 1 {\ displaystyle \ varepsilon _ {r} = \ chi +1}.
|
Диэлектрическая проницаемость
Диэлектрическая проницаемость (или статическая диэлектрическая проницаемость) материала (при данных условиях) является мерой степени, в которой материал концентрирует электростатические линии потока. На практике она измеряется как «относительная диэлектрическая проницаемость», которая определяется как отношение количества электрической энергии, запасенной в изоляторе, когда на него наложено статическое электрическое поле, к диэлектрической проницаемости вакуума (который имеет диэлектрическая проницаемость 1).
Относительная диэлектрическая проницаемость представлена как ε r (или иногда κ{\ displaystyle \ kappa}, K или Dk). Математически это определяется как: , где диэлектрическая проницаемость материала, а ε 0 – диэлектрическая проницаемость вакуума. Вакуумная диэлектрическая проницаемость выводится из уравнений Максвелла путем связывания напряженности электрического поля E к плотности электрического потока D . В вакууме (свободном пространстве) диэлектрическая проницаемость ε равна всего лишь ε 0 , поэтому диэлектрическая проницаемость равна единице.
Диэлектрическая проницаемость
Диэлектрическая проницаемость представляет собой физическую величину, которая описывает, как электрическое поле воздействует на диэлектрическую среду и как на нее влияет диэлектрическая среда, и определяется способностью материала поляризоваться в ответ на поле и тем самым уменьшать поле внутри материала . Таким образом, диэлектрическая проницаемость относится к способности материала пропускать (или «разрешать») электрическое поле.
Таким образом, диэлектрическая проницаемость относится к способности материала пропускать (или «разрешать») электрическое поле.
Непосредственно связан с электрической восприимчивостью. Например, в конденсаторе повышенная диэлектрическая проницаемость позволяет сохранять тот же заряд при меньшем электрическом поле (и, следовательно, меньшем напряжении), что приводит к увеличению емкости.
Диэлектрическая прочность
Термин диэлектрическая прочность может быть определен следующим образом:
- Для изоляционного материала диэлектрическая прочность представляет собой максимальную напряженность электрического поля, которую материал может выдержать без разрушения, то есть без потери своих изоляционных свойств.
- Для данной конфигурации диэлектрического материала и электродов диэлектрическая прочность представляет собой минимальное электрическое поле, вызывающее пробой.
Теоретическая диэлектрическая прочность материала является неотъемлемым свойством сыпучего материала и зависит от конфигурации материала или электродов, с которыми приложено поле. При пробое электрическое поле освобождает связанные электроны. Если приложенное электрическое поле достаточно сильное, свободные электроны могут разгоняться до скоростей, которые могут высвободить дополнительные электроны во время столкновений с нейтральными атомами или молекулами в процессе, называемом лавинным пробоем. Пробой происходит довольно резко (обычно за наносекунды), что приводит к образованию электропроводящей дорожки и пробивному разряду через материал. Для твердых материалов пробой серьезно ухудшает или даже разрушает их изоляционную способность.
При пробое электрическое поле освобождает связанные электроны. Если приложенное электрическое поле достаточно сильное, свободные электроны могут разгоняться до скоростей, которые могут высвободить дополнительные электроны во время столкновений с нейтральными атомами или молекулами в процессе, называемом лавинным пробоем. Пробой происходит довольно резко (обычно за наносекунды), что приводит к образованию электропроводящей дорожки и пробивному разряду через материал. Для твердых материалов пробой серьезно ухудшает или даже разрушает их изоляционную способность.
Напряженность поля пробоя
Напряженность поля, при которой происходит пробой в данном случае, зависит от соответствующей геометрии диэлектрика (изолятора) и электродов, с которыми приложено электрическое поле, а также от скорости увеличения, при которой приложено электрическое поле. Поскольку диэлектрические материалы обычно содержат незначительные дефекты, практическая диэлектрическая прочность будет составлять часть внутренней диэлектрической прочности, наблюдаемой для идеального материала без дефектов. Диэлектрические пленки обладают большей диэлектрической прочностью, чем более толстые образцы того же материала. Например, диэлектрическая прочность пленок диоксида кремния толщиной от нескольких сотен нм до нескольких микрон составляет примерно десять МВ/см. Несколько слоев тонких диэлектрических пленок используются там, где требуется максимальная практическая диэлектрическая прочность, например, в высоковольтных конденсаторах и импульсных трансформаторах.
Диэлектрические пленки обладают большей диэлектрической прочностью, чем более толстые образцы того же материала. Например, диэлектрическая прочность пленок диоксида кремния толщиной от нескольких сотен нм до нескольких микрон составляет примерно десять МВ/см. Несколько слоев тонких диэлектрических пленок используются там, где требуется максимальная практическая диэлектрическая прочность, например, в высоковольтных конденсаторах и импульсных трансформаторах.
Диэлектрики в конденсаторах с параллельными пластинами
Электроны в молекулах смещаются к положительно заряженной левой пластине. Затем молекулы создают направленное влево электрическое поле, которое частично нейтрализует поле, создаваемое пластинами. (Воздушный зазор показан для ясности; в реальном конденсаторе диэлектрик обычно находится в непосредственном контакте с пластинами.)
Помещение диэлектрического материала между пластинами в конденсаторе с параллельными пластинами вызывает увеличение емкости пропорционально k , относительная диэлектрическая проницаемость материала:
- C = kϵ0Ad {\ displaystyle C = {\ frac {k \ epsilon _ {0} A} {d}}}
- , где ϵ0{\displaystyle \epsilon _{0}} — диэлектрическая проницаемость свободного пространства, A — площадь, покрытая конденсаторами, а d — расстояние между пластинами.

Это происходит потому, что электрическое поле поляризует связанные заряды диэлектрика, создавая концентрации заряда на его поверхности, которые создают электрическое поле, противоположное (антипараллельное) полю конденсатора. Таким образом, данное количество заряда создает более слабое электрическое поле между пластинами, чем без диэлектрика, что снижает электрический потенциал. Если рассматривать этот аргумент в обратном порядке, этот аргумент означает, что в случае диэлектрика заданный электрический потенциал заставляет конденсатор накапливать большую поляризацию заряда.
Применение
Использование диэлектрика в конденсаторе дает несколько преимуществ. Самый простой из них заключается в том, что проводящие пластины можно размещать очень близко друг к другу без риска контакта. Кроме того, если подвергнуть воздействию очень сильного электрического поля, любое вещество ионизируется и становится проводником. Диэлектрики более устойчивы к ионизации, чем сухой воздух, поэтому конденсатор, содержащий диэлектрик, может подвергаться более высокому рабочему напряжению. Слои диэлектрика обычно включают в промышленные конденсаторы, чтобы обеспечить более высокую емкость в меньшем пространстве, чем конденсаторы, использующие только воздух или вакуум между их пластинами, и срок 9Диэлектрик 0395 относится к этому применению, а также к изоляции, используемой в силовых и радиочастотных кабелях.
Слои диэлектрика обычно включают в промышленные конденсаторы, чтобы обеспечить более высокую емкость в меньшем пространстве, чем конденсаторы, использующие только воздух или вакуум между их пластинами, и срок 9Диэлектрик 0395 относится к этому применению, а также к изоляции, используемой в силовых и радиочастотных кабелях.
Некоторые практические диэлектрики
Диэлектрические материалы могут быть твердыми, жидкими или газообразными. Кроме того, высокий вакуум также может быть полезным диэлектриком без потерь, даже если его относительная диэлектрическая проницаемость равна всего единице.
Твердые диэлектрики, пожалуй, наиболее часто используемые диэлектрики в электротехнике, и многие твердые тела являются очень хорошими изоляторами. Некоторые примеры включают фарфор, стекло и большинство пластмасс. Воздух, азот и гексафторид серы являются тремя наиболее часто используемыми газообразными диэлектриками.
- Промышленные покрытия, такие как парилен, обеспечивают диэлектрический барьер между подложкой и окружающей средой.

- Минеральное масло широко используется внутри электрических трансформаторов в качестве жидкого диэлектрика и для охлаждения. Диэлектрические жидкости с более высокой диэлектрической проницаемостью, такие как касторовое масло электротехнического качества, часто используются в высоковольтных конденсаторах, чтобы помочь предотвратить коронный разряд и увеличить емкость.
- Поскольку диэлектрики сопротивляются потоку электричества, поверхность диэлектрика может удерживать скрученных избыточных электрических зарядов. Это может произойти случайно при трении диэлектрика (трибоэлектрический эффект). Это может быть полезно, как в генераторе Ван де Граафа или электрофоре, или потенциально разрушительно, как в случае электростатического разряда.
- Специально обработанные диэлектрики, называемые электретами, могут сохранять избыточный внутренний заряд или «замороженную» поляризацию. Электреты имеют полупостоянное внешнее электрическое поле и являются электростатическим эквивалентом магнитов.
 Электреты имеют множество практических применений в быту и промышленности.
Электреты имеют множество практических применений в быту и промышленности. - Некоторые диэлектрики могут генерировать разность потенциалов при механическом воздействии или изменять физическую форму, если к материалу приложено внешнее напряжение. Это свойство называется пьезоэлектричеством. Пьезоэлектрические материалы представляют собой еще один класс очень полезных диэлектриков.
- Некоторые ионные кристаллы и полимерные диэлектрики обладают спонтанным дипольным моментом, который можно изменить на противоположное с помощью приложенного извне электрического поля. Такое поведение называется сегнетоэлектрическим эффектом. Эти материалы аналогичны тому, как ферромагнитные материалы ведут себя во внешнем магнитном поле. Сегнетоэлектрические материалы часто имеют очень высокие диэлектрические проницаемости, что делает их весьма полезными для конденсаторов.
См. также
- Конденсатор
- Электричество
- пьезоэлектричество
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Бетчер, Карл Йохан Фридрих.
 1980. Теория электрической поляризации: диэлектрическая поляризация . Эльзевир Наука. ISBN 0444415793
1980. Теория электрической поляризации: диэлектрическая поляризация . Эльзевир Наука. ISBN 0444415793 - Рамбл, Джон (ред.). 2017. CRC Справочник по химии и физике , 98-е изд. Бока-Ратон: CRC Press. ISBN 978-1498784542
- Фон Хиппель, Артур Р. 1994. Диэлектрики и волны . Артек Печать по требованию. ISBN 978-08
038
Внешние ссылки
Все ссылки получены 28 июля 2022 г.
- Диэлектрическая проницаемость обычных материалов
- Диэлектрическая прочность
Кредиты
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии с Энциклопедия Нового Света норм. Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Диэлектрик история
- Диэлектрическая проницаемость история
- Диэлектрическая_постоянная История
- Dielectric_strength history
История этой статьи с момента ее импорта в New World Encyclopedia :
- История компании «Диэлектрик»
Примечание. На использование отдельных изображений могут накладываться некоторые ограничения.
Оксид азота — Энциклопедия Нового Света
| Оксид азота | ||
|---|---|---|
| Общие | ||
| Молекулярная формула | НЕТ | |
| Молярная масса | 30,0061 г/моль | |
| Внешний вид | бесцветный газ | |
| CAS-номер | 10102-43-9 | |
| Недвижимость | ||
| Плотность и фаза | 1,3 × 10 3 кг м −3 (жидкий) 1,34 г дм −3 (пар) | |
| Растворимость в воде | ||
| Температура плавления | -163,6 ° С (109,6 К) | |
| Точка кипения | −151,7 ° С (121,4 К) | |
| Структура | ||
| Молекулярная форма | линейный | |
| Дипольный момент | 0,15 Д | |
| Термодинамические данные | ||
| Std энтальпия образования Δ f H | +90,2 кДж/моль | |
| Опасности | ||
| Паспорт безопасности | Внешний MSDS | |
| Классификация ЕС | Токсичные ( T ), коррозионные ( C ) | |
| NFPA 704 |
| |
| R-фразы | Р23, Р24, Р25, Р34, Р44 | |
| S-фразы | С23, С36, С37, С39 | |
| Страница дополнительных данных | ||
| Структура и свойства | n , ε r и т. д. д. | |
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газообразное | |
| Спектральные данные | УФ, ИК, ЯМР, МС | |
| Родственные соединения | ||
| Родственные оксиды азота | Закись азота Азот двуокись Азот триоксид Азот четырехокись Азот пятиокись | |
| Родственные соединения | Азотная кислота Азотистая кислота | |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) | ||
Химическое соединение оксид азота представляет собой газ с формулой NO. Это важная сигнальная молекула в организме млекопитающих, включая человека, — одна из немногих известных газообразных сигнальных молекул. Это также токсичный загрязнитель воздуха, вырабатываемый автомобильными двигателями и электростанциями.
Оксид азота (NO) не следует путать с закисью азота (N 2 O), общим анестетиком, или с диоксидом азота (NO 2 ), который является еще одним ядовитым загрязнителем воздуха.
Содержание
- 1 Производство и воздействие на окружающую среду
- 2 Технические приложения
- 3 Биологические функции
- 4 реакции
- 4.1 Подготовка
- 5 Координационная химия
- 6 Измерение концентрации оксида азота
- 7 Примечания
- 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
Молекула оксида азота представляет собой свободный радикал, что важно для понимания его высокой реакционной способности. Он реагирует с кислородом воздуха с образованием диоксида азота, о чем свидетельствует появление красновато-коричневого цвета.
Воздействие на производство и окружающую среду
С термодинамической точки зрения NO нестабилен по отношению к O 2 и N 2 , хотя это превращение происходит очень медленно при температуре окружающей среды в отсутствие катализатора. Поскольку теплота образования NO является эндотермической, для его синтеза из молекулярного азота и кислорода требуются повышенные температуры, >1000 °C. Основным естественным источником является молния. Использование двигателей внутреннего сгорания резко увеличило присутствие оксида азота в окружающей среде. Одной из целей каталитических нейтрализаторов в автомобилях является минимизация образования NO за счет каталитического превращения в O 9 .0007 2 и N 2 .
Поскольку теплота образования NO является эндотермической, для его синтеза из молекулярного азота и кислорода требуются повышенные температуры, >1000 °C. Основным естественным источником является молния. Использование двигателей внутреннего сгорания резко увеличило присутствие оксида азота в окружающей среде. Одной из целей каталитических нейтрализаторов в автомобилях является минимизация образования NO за счет каталитического превращения в O 9 .0007 2 и N 2 .
Окись азота в воздухе может преобразовываться в азотную кислоту, которая вызывает кислотные дожди. Кроме того, как NO, так и NO 2 участвуют в разрушении озонового слоя. Оксид азота (NO) представляет собой небольшой легко диффундирующий газ и вездесущую биоактивную молекулу.
Технические применения
Хотя прямого применения NO относительно немного, он производится в больших масштабах в качестве промежуточного продукта в процессе Оствальда для синтеза азотной кислоты из аммиака. В 2005 году только в Соединенных Штатах было произведено шесть миллионов метрических тонн азотной кислоты. [1] Находит применение в полупроводниковой промышленности для различных процессов. В одном из приложений он используется вместе с закисью азота для формирования оксинитридных затворов в устройствах CMOS.
В 2005 году только в Соединенных Штатах было произведено шесть миллионов метрических тонн азотной кислоты. [1] Находит применение в полупроводниковой промышленности для различных процессов. В одном из приложений он используется вместе с закисью азота для формирования оксинитридных затворов в устройствах CMOS.
Оксид азота также можно использовать для обнаружения поверхностных радикалов на полимерах. Гашение поверхностных радикалов оксидом азота приводит к включению азота, количество которого можно определить с помощью рентгеновской фотоэлектронной спектроскопии.
Биологические функции
Оксид азота является ключевым биологическим мессенджером, играющим роль в различных биологических процессах. Оксид азота, известный как фактор релаксации эндотелия, или EDRF, биосинтезируется из аргинина и кислорода различными ферментами синтазы оксида азота (NOS) и восстановлением неорганического нитрата. Эндотелий (внутренняя оболочка) кровеносных сосудов использует оксид азота, чтобы дать сигнал окружающим гладким мышцам расслабиться, тем самым расширяя артерию и увеличивая кровоток. Производство оксида азота повышено у населения, живущего на больших высотах, что помогает этим людям избежать гипоксии. Эффекты включают расширение кровеносных сосудов, нейротрансмиссию, модуляцию цикла роста волос и эрекцию полового члена. Нитроглицерин и амилнитрит служат сосудорасширяющими средствами, поскольку в организме они превращаются в оксид азота.
Производство оксида азота повышено у населения, живущего на больших высотах, что помогает этим людям избежать гипоксии. Эффекты включают расширение кровеносных сосудов, нейротрансмиссию, модуляцию цикла роста волос и эрекцию полового члена. Нитроглицерин и амилнитрит служат сосудорасширяющими средствами, поскольку в организме они превращаются в оксид азота.
Оксид азота также вырабатывается макрофагами и нейтрофилами как часть иммунного ответа человека. Оксид азота токсичен для бактерий и других патогенов человека. Многие бактериальные патогены развили механизмы устойчивости к оксиду азота. [2]
Оксид азота может способствовать реперфузионному повреждению, когда избыточное количество, образующееся во время реперфузии (после периода ишемии), реагирует с супероксидом с образованием повреждающего свободного радикала пероксинитрита. Было показано, что вдыхание оксида азота помогает выжить и восстановиться после отравления паракватом, которое вырабатывает супероксид, повреждающий легочную ткань, и препятствует метаболизму NOS.
В растениях оксид азота может продуцироваться любым из четырех путей: (i) синтазой оксида азота (как у животных), (ii) нитратредуктазой, связанной с плазматической мембраной, (iii) митохондриальной цепью переноса электронов, или ( iv) неферментативными реакциями. Это сигнальная молекула, действует в основном против окислительного стресса, а также играет роль во взаимодействиях с патогенами растений. Было показано, что обработка срезанных цветов и других растений оксидом азота увеличивает время до увядания. [3]
Биологически важной реакцией оксида азота является S-нитрозирование (или S-нитрозилирование), ковалентное присоединение оксида азота к тиоловой группе цистеина в белках. S-нитрозилирование было описано некоторыми его сторонниками как механизм динамической посттрансляционной регуляции большинства или всех основных классов белков. Твердые доказательства в поддержку этого утверждения ограничены.
Реакции
Под воздействием кислорода NO превращается в NO 2 .
- 2NO + O 2 → 2NO 2
Предполагается, что это превращение происходит через промежуточное соединение ONOONO. В воде NO реагирует с кислородом и водой с образованием HNO 2 или азотистой кислоты. Предполагается, что реакция протекает по следующей стехиометрии:
- 4 NO + O 2 + 2 H 2 O → 4 HNO 2
NO будет реагировать с фтором, хлором и бромом с образованием соединений XNO, известных как нитрозилгалогениды, таких как нитрозилхлорид. Нитрозилйодид может образовываться, но он чрезвычайно короткоживущий и имеет тенденцию к восстановлению I 2 .
- 2NO + Cl 2 → 2NOCl
Нитроксил (HNO) представляет собой восстановленную форму оксида азота.
Подготовка
Как отмечалось выше, окись азота производится в промышленных масштабах прямой реакцией O 2 и N 2 при высоких температурах. В лаборатории его удобно получать восстановлением азотной кислоты:
В лаборатории его удобно получать восстановлением азотной кислоты:
- 8HNO 3 + 3Cu → 3Cu(NO 3 ) 2 + 4H 2 O + 2NO
Его также можно получить восстановлением азотистой кислоты:
- 2 NaNO 2 + 2 NaI + 2 H 2 SO 4 → I 2 + 4 NaHSO 4 + 2 NO
- 2 NANO 2 + 2 FESO 4 + 3 H 2 SO 4 → FE 2 (так 4 ) 3 + 2 Нахсо 4 + 2 H 2 O + O + O + O + O + O + O + O +. 2 №
- 3 КНО 2 (л) + КНО 3 (л) + Cr 2 O 3 (с) → 2 K 2 CrO 4 (с) + 4 NO (г)
Путь с использованием сульфата железа (II) прост и использовался в студенческих лабораторных экспериментах .
В промышленных масштабах NO получают окислением аммиака при температуре от 750 до 900 °C (обычно при 850 °C) в присутствии платины в качестве катализатора:
- 4NH 3 + 5O 2 → 4NO + 6H 2 O
Некатализируемая эндотермическая реакция O 2 и N 2 , которые возникают при высоких температурах (выше 2000 ° C) с молнией, не были преобразованы в практический коммерческий синтез. Реакцию можно записать так:
Реакцию можно записать так:
- N 2 + O 2 → 2NO
Координационная химия
Оксид азота образует комплексы со всеми переходными металлами с образованием комплексов, называемых нитрозилами металлов. Наиболее распространенным способом связывания NO является терминальный «линейный» тип, при котором угол группы M-N-O варьируется от 160 до 180 градусов. В этом случае группа NO формально считается донором трех электронов. В качестве альтернативы можно рассматривать такие комплексы как производные NO + , который изоэлектронен с CO.
В других комплексах группа M-N-O характеризуется углом между 120-140 градусами. В таких случаях оксид азота считается «одноэлектронным псевдогалогенидом».
Группа NO также может образовывать мостик между металлическими центрами через атом азота в различных геометриях.
Измерение концентрации оксида азота
Концентрацию оксида азота можно определить с помощью простой хемилюминесцентной реакции с участием озона: Образец, содержащий оксид азота, смешивают с большим количеством озона. Оксид азота реагирует с озоном с образованием кислорода и диоксида азота. Эта реакция также производит свет (хемилюминесценция), который можно измерить с помощью фотодетектора. Количество производимого света пропорционально количеству оксида азота в образце.
Оксид азота реагирует с озоном с образованием кислорода и диоксида азота. Эта реакция также производит свет (хемилюминесценция), который можно измерить с помощью фотодетектора. Количество производимого света пропорционально количеству оксида азота в образце.
- NO + O 3 → NO 2 + O 2 + свет
Другие методы тестирования включают электроанализ, при котором NO реагирует с электродом, вызывая изменение тока или напряжения.
Примечания
- ↑ «Производство: Рост — это норма». Новости химии и техники (10 июля 2006 г.): 59.
- ↑ Джейнвей. С.А. и др. Иммунобиология: иммунная система в норме и при патологии 6-е изд. Нью-Йорк: Garland Science, 2005. ISBN 0815341016.
- ↑ Сигель-Ицкович, Джуди. «Виагра заставляет цветы стоять прямо». Студент BMJ (7 сентября 1999 г.). Проверено 20 мая 2007 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Батлер, А.
 Р. и Р. Николсон. 2003. Жизнь, смерть и оксид азота . Кембридж, Великобритания: Королевское химическое общество. ISBN 0854046860
Р. и Р. Николсон. 2003. Жизнь, смерть и оксид азота . Кембридж, Великобритания: Королевское химическое общество. ISBN 0854046860
- Коттон, Ф. Альберт, Джеффри Уилкинсон, Карлос А. Мурильо и Манфред Бохманн. 1999. Высшая неорганическая химия . 6-е издание. Нью-Йорк: Уайли. ISBN 0471199575
- Фаассен, Эрнст ван и Анатолий Ф. Ванин (ред.). 2007. Радикалы для жизни: различные формы оксида азота . Амстердам: Эльзевир. ISBN 0444522360
- Ланкастер, Джек-младший, 1996. Оксид азота: принципы и действия . Сан-Диего, Калифорния: Academic Press. ISBN 0124355552
Внешние ссылки
Все ссылки получены 5 декабря 2018 г.
- Нобелевская премия по физиологии и медицине 1998 г. (Роль оксида азота в сердечно-сосудистой регуляции.)
- Диабетические часы: оценка потенциала оксида азота в диабетической стопе. PodiatryToday .
Авторы
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Оксид азота история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Окиси азота»
Примечание. На использование отдельных изображений, которые лицензируются отдельно, могут распространяться некоторые ограничения.
Двуокись азота — Энциклопедия Нового Света
Материал из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущая (азотный цикл)
Следующая (азотфиксация)
| Идентификаторы | |
|---|---|
| Номер CAS | [10102-44-0] |
| Недвижимость | |
| Молекулярная формула | НЕТ 2 |
| Молярная масса | 46. 0055 0055 |
| Внешний вид | коричневый газ |
| Плотность | 1443 кг/м³, жидкость 3,4 кг/м³, газ при 294,25 К |
| Температура плавления | -11,2°С (261,95 К) |
| Температура кипения | 21,1°С (293,25 К) |
| Опасности | |
| Классификация ЕС | Высокотоксичный ( T+ ) |
| NFPA 704 | 3
|
| R-фразы | Р26, Р34 |
| S-фразы | С1/2, С9, С26, С28, С36/37/39, С45 |
| Если не указано иное, данные приведены для материалы в их стандартном состоянии (при 25 °C, 100 кПа) | |
Двуокись азота представляет собой химическое соединение с формулой NO 2 . Это один из нескольких оксидов азота. При обычных температурах и атмосферном давлении это красновато-коричневый газ с характерным резким резким запахом. Это один из самых известных загрязнителей воздуха и яд при вдыхании. Этот газ присутствует в небольших количествах в смоге и выхлопных газах автомобилей. Однако химики считают его полезным в качестве катализатора, нитрующего агента и окислителя.
Это один из нескольких оксидов азота. При обычных температурах и атмосферном давлении это красновато-коричневый газ с характерным резким резким запахом. Это один из самых известных загрязнителей воздуха и яд при вдыхании. Этот газ присутствует в небольших количествах в смоге и выхлопных газах автомобилей. Однако химики считают его полезным в качестве катализатора, нитрующего агента и окислителя.
Содержимое
- 1 Подготовка
- 2 Вопросы безопасности и загрязнения
- 3 Оксиды азота
- 4 См. также
- 5 Примечания
- 6 Каталожные номера
- 7 Внешние ссылки
- 8 кредитов
Препарат
Газообразный диоксид азота (NO 2 ) превращается в бесцветный газ тетраоксид азота (N 2 O 4 ) при низких температурах и снова превращается в NO 2 при более высоких температурах. Обе бутылки на этой фотографии содержат одинаковое количество газа при разных температурах.
Двуокись азота (NO 2 ) получают простой реакцией азотной кислоты (HNO 3 ) на металлическую медь. Реакция следующая:
- 4HNO 3 (водн.) + Cu(s) → Cu(NO 3 ) 2 (водн.) + 2NO 2 (г) + 2H 2 909 9 360 O(L) Безопасность и соображения загрязнения
Двуокись азота токсична при вдыхании. Симптомы отравления (отека легких), как правило, появляются через несколько часов после вдыхания низкой, но потенциально смертельной дозы. Кроме того, низкие концентрации (4 части на миллион) анестезируют нос, что создает возможность передозировки.
Длительное воздействие NO 2 при концентрациях выше 40–100 мкг/м³ вызывает неблагоприятные последствия для здоровья [1] .
Двуокись азота образуется в большинстве процессов горения с использованием воздуха в качестве окислителя. При повышенных температурах азот соединяется с кислородом с образованием диоксида азота:
- 2O 2 + N 2 → 2 NO 2
Наиболее важными источниками NO 2 являются двигатели внутреннего сгорания [2] в меньшей степени, тепловые станции , целлюлозные заводы.
 [3]
[3] На приведенной ниже карте, отображающей результаты спутниковых измерений над Европой, двуокись азота показана как крупномасштабный загрязнитель с фоновыми концентрациями на уровне земли в сельской местности в некоторых районах около 30 мкг/м³, что немногим ниже нездоровых уровней. Двуокись азота играет роль в химии атмосферы, включая образование тропосферного озона. Недавнее исследование ученых из Калифорнийского университета в Сан-Диего предполагает связь между NO 9 и0007 2
уровней и синдром внезапной детской смерти. [4]NO 2 уровни загрязнения в Европе с января 2003 г. по июнь 2004 г.
Оксиды азота
- Закись азота или N с CO 2 , но с несимметричным расположением атомов (NNO)
- Оксид азота или NO, проблемный загрязнитель с коротким сроком жизни, поскольку он превращается в NO2 в присутствии свободного кислорода.
- NO x = все вышеперечисленное в неопределенных пропорциях, но с тенденцией к NO 2 .

Более экзотические оксиды азота включают N 2 O 5 и синий вид N 2 O 3 .
Существуют окисленные (катионные) и восстановленные (анионные) производные многих из этих оксидов: нитрит (NO 2 − ), нитрат (NO 3 − ), нитроний или NO 28 9 , и нитрозоний или NO + . NO 2 занимает промежуточное положение между нитритом и нитронием:
- № 2 + + e − → № 2
- NO 2 + e − → NO 2 −
См. также
- Загрязнение воздуха
- Азотная кислота
- Оксид азота
- Азот
- Закись азота
- Кислород
- Загрязнитель
Примечания
- ↑ Аспекты загрязнения воздуха твердыми частицами, озоном и диоксидом азота для здоровья.
 Проверено 25 мая 2008 г. .
Проверено 25 мая 2008 г. . - ↑ Сон, Бусун и Вонхо Ян, Патрик Брейсс, Тэвунг Чунг и Ёншин Ли (март 2004 г.). Оценка профессионального и непрофессионального воздействия диоксида азота на корейских водителей такси с использованием модели микроокружающей среды. Экологические исследования 94 (3): 291-296.
- ↑ Выбросы в атмосферу. Ботния. Проверено 25 мая 2008 г.
- ↑ Сиды связаны с загрязнением диоксидом азота. Проверено 25 мая 2008 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Чанг, Рэймонд. 2006. Химия, 9-е изд. Нью-Йорк: McGraw-Hill Science/Engineering/Math. ISBN 0073221031 .
- Коттон, Ф. Альберт, Джеффри Уилкинсон, Карлос А. Мурильо и Манфред Бохманн. 1999. Передовая неорганическая химия 6-е изд. Нью-Йорк: Уайли. ISBN 0471199575.
- Sloss, Leslie L. 1992. Книга фактов о технологиях контроля оксидов азота. Парк-Ридж, Нью-Джерси: ISBN Noyes Data Corp.



 В то же время это соединение можно назвать самым безопасным средством для наркоза, так как после его применения почти не бывает осложнений. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания.
В то же время это соединение можно назвать самым безопасным средством для наркоза, так как после его применения почти не бывает осложнений. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде.
После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде.




 В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами.
В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами.
 Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончанию.
Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончанию.


 В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами.
В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами.
 Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончанию.
Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончанию.


 В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами.
В большинстве случаев применяют комбинированный наркоз, при котором закись азота сочетают с другими, более мощными, средствами для наркоза, а также с миорелаксантами.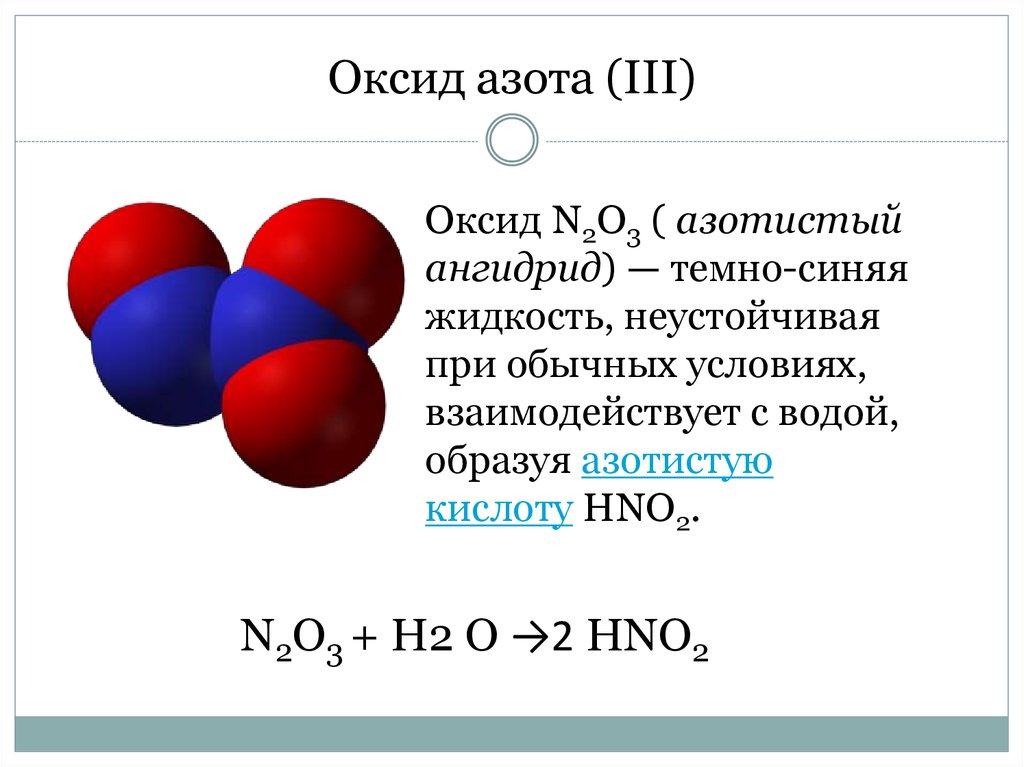
 Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончанию.
Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончанию.